
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
分析 (1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
(2)根据实验的目的和影响化学反应速率的因素来设计实验;
(3)①根据0.01KMnO4酸性溶液前后三次褪色时间差距较大,应舍去,所以用0.001KMnO4酸性溶液三次褪色来计算:先求出反应开始时c(KMnO4),然后求出三次褪色的平均时间,最后根据ν(KMnO4)=$\frac{△c}{△t}$进行计算;
②根据KMnO4的物质的量不同来分析;
(4)酸性条件下,高锰酸根离子能将氯离子氧化成氯气;
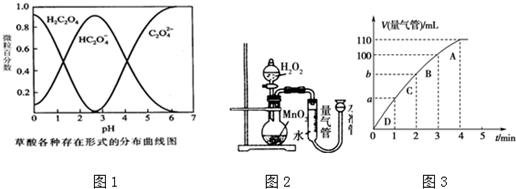
(5)①根据图象确定生成氧气的体积;
②图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,由于反应物浓度减小,反应速率减小,3min~4min生成10mL气体,那么2min~3min生成气体的体积应大于10mL,故b小于90mL.
解答 解:(1)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2↑+2Mn2++8H2O;
(2)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,
实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响,则实验①②的温度、催化剂的用量相同,只有浓度不同;实验①③的温度不同,则实验目的是探究温度对化学反应速率的影响,则①③中只有温度不同,其他条件相同;实验①④应该是探究催化剂对反应速率的影响,则①④中只有催化剂的用量不同,其他条件相同,据此完成表格为:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | b.③ c.④ | |||
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | ||
| ④ | 298 | 0 | 0.010 |
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | b.③ c.④ | |||
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | ||
| ④ | 298 | 0 | 0.010 |
点评 本题主要结合实验考查了外界条件对化学反应速率的影响,反应速率的计算,图象和表格的信息量大,平时要多练习,培养较强的分析问题、解决问题的能力.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| B. | 2.24 L CO2中含有的原子数为0.3×6.02×1023 | |
| C. | 200 mL 5 mol•L-1 Na2CO3溶液中,含6.02×1023个CO32- | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | .①②③④⑤ | C. | .①②③⑥⑧ | D. | .③④⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ba(OH)2溶液与H2SO4溶液反应:Ba2++2H++2OH-+SO42-═BaSO4↓+2H2O | |
| C. | Na2CO3溶液与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NH4Cl 溶液显酸性:NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 标准状况下,22.4L盐酸含有NA个HC1分子 | |
| C. | 1Lmol•L-1的NaC1O溶液中含有C1O-的数目为NA | |
| D. | 1molNa被完成氧化生成Na2O2,失去个2NA电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3{M}_{1}}$ | C. | $\frac{4m-1}{13}$mL | D. | $\frac{3}{m-n}$mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量NaCl溶液的方法除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | |
| C. | 分离FeCl3、KCl、BaSO4的固体混合物,应采用的一组试剂是:水、氢氧化钠、盐酸 | |
| D. | 先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com