
【题目】下列离子方程式中,正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.碳酸钠溶液显碱性:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
C.氯气通入冷水中:Cl2 +H2O ![]() Cl-+ClO-+2H+
Cl-+ClO-+2H+
D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O
 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol。下列结论中正确的是
A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.稀硫酸与稀Ba(OH)2溶液反应生成2mol水,放出2×57.3kJ的热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解等,依据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6mol·L-1,该温度下,pH=10的NaOH溶液的物质的量浓度为___。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NH3·H2O③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序为___(填标号)。
(3)25℃时,将amol·L-1的醋酸和bmol·L-1的氢氧化钠溶液等体积混合后,溶液的pH=7,则a___b(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
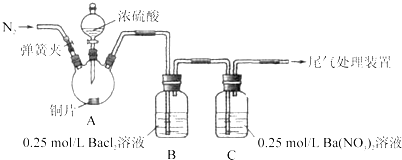
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】槟榔碱( )为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
)为油状液体,有拟胆碱作用,在医疗上用于治疗青光眼。某学生设计了以X为原料的合成路线如下:
X(C5H8O2) ![]() A(C5H11O2N)
A(C5H11O2N)![]() B(C10H19O4N)
B(C10H19O4N)![]() C(C8H13O3N)
C(C8H13O3N)![]() D(C8H15O3N)
D(C8H15O3N)![]() E(
E(![]() )
)![]() F(C7H11O2N)
F(C7H11O2N)![]() G(槟榔碱)
G(槟榔碱)
已知:① X能使溴水褪色、能水解,水解产物之一为乙醇。
②CH3COOC2H5 ![]() CH3COCH2COOC2H5
CH3COCH2COOC2H5
③CH3COOH ![]() CH2BrCOOH
CH2BrCOOH
(1)C的结构简式:_________________________
(2)下列说法不正确的是:______________
A.化合物A有氨基和酯基两种官能团
B.化合物D有碱性
C.由结构推断化合物E可能溶于水
D.化合物F可以使溴水和KMnO4溶液褪色,原理相同
(3)D→E 反应的方程式:_________________________________
(4)烟酸( )也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
)也可以合成槟榔碱。写出符合下列条件的烟酸可能的同分异构体的结构简式____________。
①含且只含有一个六元环,环上无氧原子 ②1H-NMR谱表明分子中有3种氢原子
(5)请设计由乙醇和丙酸为原料合成化合物X的路线,(用流程图表示,试剂任选)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芝加哥伊利诺伊大学的研究人员设计了一种可用于商业化的新型锂金属电池,电池结构如图所示: 电池工作时,下列说法错误的是
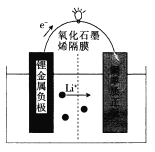
A. 该装置将化学能转化为电能
B. 负极上发生的电极反应为Li- e-= Li+
C. 该电池可用LiOH溶液作电解质
D. 电池工作时,电路中每流过1 mol电子,正极增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是
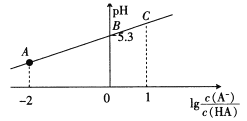
A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式: B________,C________,D________,E________。
(2)写出下列反应的化学方程式:
①A生成B:____________________;
②B与水反应生成E:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com