
 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g) 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:不详 题型:单选题
 2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是| 组序号 | 1 | 2 | 3 | 4 | |
| 反应温度/℃ | 225 | 235 | 225 | 235 | |
| 反应前气体的物质的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
| CO | 3.0 | 3.0 | 2.8 | 2.8 | |
| H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
| 平衡时CH3OH的体积分数/% | 4.9 | 8.8 | 36.5 | 50.7 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
2C(g)+2D(g),下列描述中能说明该反应达到平衡的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=" 0.100" mol·L-1 c(B)="0.200" mol·L-1c(C)="0" mol·L-1。反应物A的浓度随时间的变化如下图所示。下列说法正确的是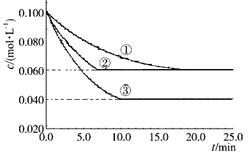
 C(g)的ΔH >0
C(g)的ΔH >0 查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NH3(g);△H<0
2NH3(g);△H<0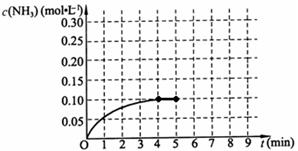
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题, 3C(g) 反应已经达到平衡的是( )
3C(g) 反应已经达到平衡的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是
2SO3(g) DH <0在一定温度下其平衡数为K,下列说法正确的是| A.增大SO2的转化率K值一定增大 | B.减小压强K值减小 |
| C.升高温度K值增大 | D.K值越大SO2转化率越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态, 生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白: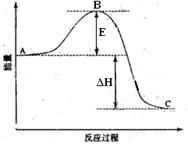 (6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。
(6)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4/3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com