
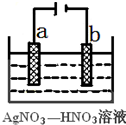
 ��1������������ұ����Ӧ����ʱ���õ�ⷨ����bd��
��1������������ұ����Ӧ����ʱ���õ�ⷨ����bd������ ��1����ⷨ��ұ�����ý���K��Ca��Na��Mg��Al��һ���õ�����ڵ��Ȼ��Al�ǵ�����ڵ��������������Ƶã��Ȼ�ԭ����ұ���ϲ����õĽ���Zn��Fe��Sn��Pb��Cu�����û�ԭ���У�C��CO��H2�ȣ����ȷֽⷨ��Hg��Ag�ü��ȷֽ�������ķ����Ƶã��������뷨��Pt��Au����������ķ����Ƶã�
��2����⾫����ʱ����������������b������������ɫ�������ɣ���b�缫����������ӵõ������ɶ���������
��3���������ͭ��Һ����Һ�����ԣ���������Һ�м����ʽ̼��ͭ�ָܻ�ԭ��Һ����ʽ̼��ͭ�����ᷴӦ��������ͭ��ˮ�Ͷ�����̼����Һ�������ӵ�����ͭ�����������ӣ�����ʵ���ϵ������ͭ��Һ�������Σ���һ��2CuSO4+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+O2��+2H2SO4���ڶ��Σ�2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2H2��+O2����
����ʽ̼��ͭ��ѧʽ�ı�Ϊ2CuO•H2O•CO2�����Լ���0.1molCu2��OH��2CO3 ���൱�ڼ���0.2molCuO��0.1molˮ����������ͭ��ˮ�������㼴�ɣ�
��4���������������Һ������������������·��ÿת��12 mol���ӣ������1 mol Cr2O72-����ԭ������2mol��Cr��OH��3��
��� �⣺��1�����ý������õ�ⷨұ�����ơ������ǻ��ý��������õ������̬NaCl��Al2O3�ķ���ұ������ѡbd��
��2����⾫��ʱ�����������������Դ�����a����
b�缫��������������ԭ��Ӧ�������˺���ɫ������NO2���缫��Ӧ��NO3-+e-+2H+=NO2��+H2O��
�ʴ�Ϊ��a��NO3-+e-+2H+=NO2��+H2O��
��3���������ͭ��Һ����Һ�����ԣ���������Һ�м����ʽ̼��ͭ�ָܻ�ԭ��Һ����ʽ̼��ͭ�����ᷴӦ��������ͭ��ˮ�Ͷ�����̼����Һ�������ӵ�����ͭ�����������ӣ�����ʵ���ϵ������ͭ��Һ�������Σ�
��һ��2CuSO4+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2Cu+O2��+2H2SO4��
�ڶ��Σ�2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2H2��+O2����
����ʽ̼��ͭ��ѧʽ�ı�Ϊ2CuO•H2O•CO2�����Լ���0.1molCu2��OH��2CO3 ���൱�ڼ���0.2molCuO��0.1molˮ��
��һ�Σ�����ͭԭ���غ�֪���������ͭ��Һ����n��Cu��=n��CuO��=0.2mol��ת�Ƶ��ӵ����ʵ���=0.2mol��2=0.4mol��
�ڶ��Σ��������0.1molˮת�Ƶ��ӵ����ʵ���=0.1mol��2=0.2mol��
���Ե������й�ת�Ƶĵ�����Ϊ0.4mol+0.2mol=0.6mol���ʴ�Ϊ��0.6��
��4����������������ԭ��Ӧ����Һ�е������ӵõ����Ӽ��٣����Ե缫��ӦʽΪ��2H++2e-=H2������·��ÿת��12 mol���ӣ������1 mol Cr2O72-����ԭ������2mol��Cr��OH��3��������1mol Cr��OH��3ʱ����·��ת�Ƶ��ӵ����ʵ�������Ϊ$\frac{12}{2}$=6mol���ʴ�Ϊ��2H++2e-=H2����6��
���� ���⿼����ԭ����������ԭ��Ӧ�ȣ���������ĵ缫��Ӧ�ǽ���Ĺؼ����Ƕ�ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �κ�����£��¶ȶ������ܶԷ�Ӧ�ķ�������������� | |
| B�� | pH=4��CH3COOH��NH4Cl��Һ�У�ˮ�ĵ���̶���ͬ | |
| C�� | ��pH��ֽ�ⶨ��ҺpH����ȷ�����ǣ���һС����ֽ�ڴ���Һ��պһ�£�ȡ������ڱ������ϣ������ɫ������ | |
| D�� | pH=4.5�ķ���֭��c��H+����pH=6.5��ţ����c��H+����100�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
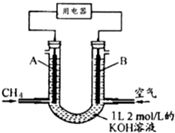 CH4ȼ�ϵ�أ�װ��ʾ����ͼ��A��BΪ�����̼����������ͨ����飬�ڱ�״���£����ļ������VL����0��V��44.8Lʱ������ܷ�Ӧ����ʽΪCH4+2O2+2KOH=K2CO3+3H2O��
CH4ȼ�ϵ�أ�װ��ʾ����ͼ��A��BΪ�����̼����������ͨ����飬�ڱ�״���£����ļ������VL����0��V��44.8Lʱ������ܷ�Ӧ����ʽΪCH4+2O2+2KOH=K2CO3+3H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ�����ã�
������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ�����ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.4mol/L | B�� | 0.2mol/L | C�� | 0.1mol/L | D�� | 0.08mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ϊ17��������Ϊ20����ԭ�ӣ�${\;}_{17}^{20}$Cl | |
| B�� | H2CO3�ĵ��뷽��ʽ��H2CO3?2H++CO32- | |
| C�� | Na2O2�ĵ���ʽ��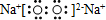 | |
| D�� | ��ϩ���ӵĽṹ��ʽ��CH2CH2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������������2Fe��OH��3+6H++2I-�T2Fe2++I2+6H2O | |
| B�� | ��Na2SiO3��Һ��ͨ�����SO2��SiO32-+SO2+H2O�TH2SiO3��+SO32- | |
| C�� | ��0.3mol/LNaClO��Һ�еμӵ������0.2mol/LNaHSO3��Һ��2HSO3-+4ClO-�T2SO42-+2Cl-+2HClO | |
| D�� | ��⻯������Һ�еμ�������Ȼ�̼��Һ2Br2+2Fe2++2I-�TI2+4Br-+2Fe3+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com