
【题目】常温下,下列各组离子中,在溶液中能大量共存的是( )
A. CO32-、S2-、NO3-、Ca2+B. Al3+、Na+、S2-、SO42-
C. Al3+、NH4+、K+、SO42-D. Fe2+、Ca2+、H+、NO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有pH=3的HCl溶液100 mL,要使它的pH=4,如果加入蒸馏水,需加水_____ mL (假定溶液体积有加和性,下同)。
(2)常温下,将pH=8的NaOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=_______。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是______________.(填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4P(红磷s) ![]() P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
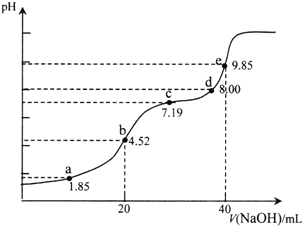
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试完成下列问题:(提示:氢氧化钙的溶解度随温度升高而降低)

(1)实验中观察到的现象是______________________________________;
(2)产生上述现象的原因是______________________________________。
(3)写出有关反应的离子方程式____________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量_____________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(5)如将本题中“25℃石灰水饱和溶液”换成“20℃碳酸饮料”进行探究实验,实验(1)中观察到的另一现象是________________,其原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com