
 如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是CO2,Y是饱和NaHCO3浓溶液 | ||
| C. | X是SO2,Y是NaOH溶液 | D. | X是HCl,Y是NaNO3稀溶液 |
分析 锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起,则Y中液体与X发生化学反应或溶解,导致锥形瓶中气体减少,以此来解答.
解答 解:由信息可知,中液体与X发生化学反应或溶解,导致锥形瓶中气体减少符合题意,则
A.氨气易溶于水,符合题意,故A不选;
B.二氧化碳不溶于碳酸氢钠,且不反应,不符合题意,故B选;
C.二氧化硫与NaOH溶液反应,符合题意,故C不选;
D.HCl极易溶于水溶液,符合题意,故D不选;
故选B.
点评 本题考查实验装置的综合及元素化合物知识,为高频考点,把握物质的性质、发生的反应及习题中的信息为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
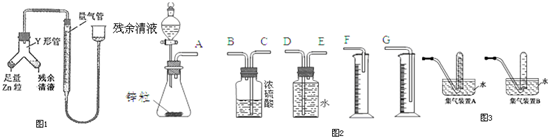
 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.
铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台的铁圈上,下面放置盛沙的蒸发皿.将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
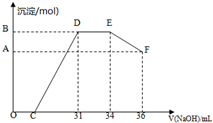
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
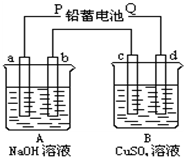 用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠保存在煤油中,以隔绝空气 | 常温下,金属钠在空气中会生成过氧化钠 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可用于航天员的供氧剂 | Na2O2能和CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH4中含有原子数目约为NA | |
| B. | 标准状况下,NA个H2O分子的体积约为22.4L | |
| C. | 常温常压下,NA个D2O分子的质量约为20g | |
| D. | 1L 0.5mol/L AlCl3溶液中含有的Al3+数目约为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com