
|
随着卤素原子核电荷数的增加,下列递变规律正确的是 | |
| [ ] | |
A. |
单质的熔沸点逐渐降低 |
B. |
气态氢化物的稳定性逐渐减弱 |
C. |
卤素离子的还原性逐渐减弱 |
D. |
卤素单质的氧化性逐渐增强 |
科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
F2+H2 2HF 2HF |
1.8×1036 | 1.9×1032 |
Cl2+H2 2HCl 2HCl |
9.7×1012 | 4.2×1011 |
Br2+H2 2HBr 2HBr |
5.6×107 | 9.3×106 |
I2+H2 2HI 2HI |
43 | 34 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2=2HBr | 5.6×107 | 9.3×106 |
| I2+H2=2HI | 43 | 34 |
| A、在相同条件下随着卤素原子核电荷数的增加,平衡时X2的转化率逐渐降低 |
| B、t2>t1,HX的生成反应是吸热反应 |
| C、随着卤素原子核电荷数的增加HX的还原性逐渐减弱 |
| D、随着卤素原子核电荷数的增加HX的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2 | 1.8×1036 | 1.9×1032 |
| Cl2+H2 | 9.7×1012 | 4.2×1011 |
| Br2+H2 | 5.6×107 | 9.3×106 |
| I2+H2 | 43 | 34 |
⑴已知t2>t1,HX的生成反应是 反应(填“吸热”或“放热”)。
⑵HX的电子式是 。
⑶共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是 。
⑷X2都能与H2反应生成HX,用原子结构解释原因: 。
⑸K的变化体现出X2化学性质的递变性,用原子结构解释原因: ,原子半径逐渐增大,得电子能力逐渐减弱。
⑹仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加, (选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
查看答案和解析>>
科目:高中化学 来源:2012届山东省济南市高三12月月考化学试卷 题型:填空题
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
F2+H2  2HF 2HF | 1.8 × 1036 1036 | 1.9 ×1032 |
Cl2+H2  2HCl 2HCl | 9.7 ×1012 | 4.2 ×1011 |
Br2+H2  2HBr 2HBr | 5.6 ×107 | 9.3 ×106 |
I2+H2  2HI 2HI | 43 | 34 |
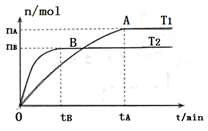
 态
态查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省金华一中高二下学期期中考试化学试卷(带解析) 题型:填空题
(8分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
F2+H2  2HF 2HF | 1.8 ×1036 | 1.9 ×1032 |
Cl2+H2 2HCl 2HCl | 9.7 ×1012 | 4.2 ×1011 |
Br2+H2  2HBr 2HBr | 5.6 ×107 | 9.3 ×106 |
I2+H2 2HI 2HI | 43 | 34 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com