
【题目】在一定条件下,恒容的密闭容器中发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
2SO3(g),反应过程中某一时刻测得SO2、O2SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,可能出现的数据是
A. c(O2)=0.3mol/L B. c(SO3)+c(SO2)=0.4 mol/L
C. c(S03)=0.4 mol/L D. c(S03)+c(SO2)=0.15mol/L
【答案】B
【解析】A. O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,由方程式2SO2(g)+O2(g)2SO3(g)可知O2的浓度变化为0.1mol/L,实际变化应小于该值,故c(O2)小于0.2mol/L,故A错误;B. 由于硫元素守恒,c(SO3)+c(SO2)=0.2molL1+0.2molL1=0.4molL1,c(SO3)小于0.4mol/L,故B正确; C.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,由方程式2SO2(g)+O2(g)2SO3(g)可知SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故c(SO3)小于0.4mol/L,故C错误; D. 由于硫元素守恒,c(SO3)+c(SO2)=0.2molL1+0.2molL1=0.4molL1,故D错误;本题选B。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:
Ni(OH)2+5CH3NC=(CH3NC)4Ni +CH3NCO+H2O
⑴Ni2+基态核外电子排布式为___________。
⑵CH3NC(其结构简式为![]() )分子中碳原子轨道的杂化类型是___________;
)分子中碳原子轨道的杂化类型是___________;
 1 molCH3NC中σ键的数目为___________。
1 molCH3NC中σ键的数目为___________。
⑶用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。
①与COCl2互为等电子体的一种阴离子为___________。
②甲胺极易溶于水,除因为它们都是极性分子外,还因为___________。
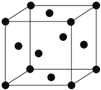
⑷Ni单质的晶胞结构如右图所示,每个晶胞中含Ni原子数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取.收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
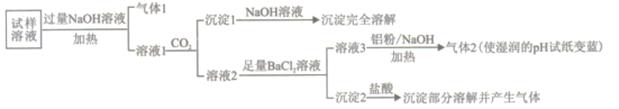
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记接着问环保局长:如果玻璃酒瓶属于可回收垃圾,你知道酒瓶玻璃的主要成份
A. 2CaO·SiO2 B. 3CaO·Al2O3 C. CaO·PbO·6SiO2 D. Na2O·CaO·6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种不同的物质中均含有同一种元素,它们之间存在如图所示的转化关系(部分反应物及生成物已略去).请回答下列问题:

(1)若常温时B为红棕色气体,C为无色气体,则B生成C的化学方程式:____________________________
(2)若常温时A为气态氢化物,B为淡黄色固体,C为气体,则CO2中混有少量气体C杂质可以用__________来除(写一种即可).
(3)若A为碱性氧化物,B为工业制玻璃的主要原料之一,常温时0.1mol/L的C溶液的pH值为13,则反应①的方程式为_______________________检验A、B、C中共有的金属离子的方法是 ____________。
(4)若常温时A为气体单质,①②③④均为化合反应,C的相对分子质量大于B,则C的电子式为:__________。
(5)若A是第三周期某金属的氧化物,B、C均为正盐且B的水溶液呈酸性,C的水溶液呈碱性。请写出反应③的离子方程式:______________________________________________________。
(6)若反应②③④均为化合反应,反应①为置换反应。当A为一种金属单质时,B中阳离子的检验方法为 ____________________________________________。(写出具体操作过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
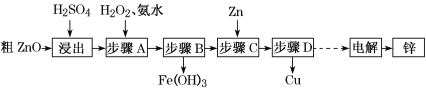
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
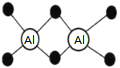
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。这种电池在工作时的电极反应为:2H2 +4OH-- 4e-===4H2O ;O2+2H2O+4e-===4OH-。下列叙述不正确的是
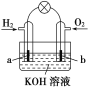
A. H2在负极上发生氧化反应
B. 电子由b极流向a极
C. 总反应方程式为2H2+O2===2H2O
D. OH-向b极区移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com