
| 实验操作 | 实验现象 | 结论 |
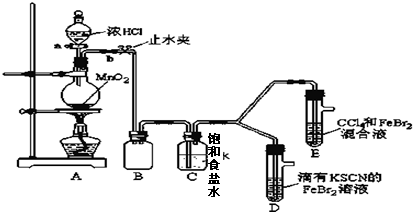
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 关闭活塞a,点燃酒精灯. (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化.一段时间后CCl4层由无色变为橙色.(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. |
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
分析 (1)①A中浓盐酸与二氧化锰加热反应生成氯化锰、氯气和水;②氯气有毒不能直接排空,要用碱液吸收尾气;
(2)打开活塞a,向圆底烧瓶中滴入适量浓盐酸,然后关闭活塞a,点燃酒精灯加热;亚铁离子的还原性比溴离子强,氯气首先氧化亚铁离子,再氧化溴离子;
(3)①过量氯气和SCN-反应SCN-浓度减小,根据铁离子和硫氰根离子反应平衡原理分析;
向溶液中加入氯化铁或硫氰化钾溶液根据溶液颜色变化判断;
②氯化溴能发生水解反应生成酸,根据AgBrO、AgCl的溶解性分析.
解答 解:(1)①浓盐酸与二氧化锰加热反应生成氯化锰、氯气和水,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O;
②由于氯气有毒,直接排放到空气中会污染大气,要用碱液吸收尾气,实验装置缺少尾气处理装置,故答案为:缺少尾气处理装置;
(2)打开活塞a,向圆底烧瓶中滴入适量浓盐酸,然后关闭活塞a,点燃酒精灯加热;亚铁离子的还原性比溴离子强,氯气首先氧化亚铁离子,再氧化溴离子,所以D装置中首先变红,CCl4层由无色变为橙色,故答案为:关闭活塞a,点燃酒精灯;CCl4层由无色变为橙色;
(3)①过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色,为检验其褪色原因,检验方法为:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理;或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理,
故答案为:过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则使Fe3++3SCN-?Fe(SCN)3平衡向逆反应方向移动而褪色;KSCN溶液;变红色;(或FeCl3溶液,不变红);
②过量的氯气和溴反应生成氯化溴,氯化溴不稳定,易和水反应生成盐酸和次溴酸,BrCl+H2O=HBrO+H++Cl-,氯离子和银离子反应生成白色沉淀氯化银,Ag++Cl-=AgCl↓,次溴酸和银离子反应生成次溴酸银易溶于水,所以生成的白色沉淀为氯化银,
故答案为:BrCl+H2O=HBrO+H++Cl-、Ag++Cl-=AgCl↓.
点评 本题考查了性质实验方案设计,明确反应原理是解本题关键,结合资料分析解答,会根据离子反应方程式判断氧化性强弱,会根据实验现象确定发生的反应,难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 实验室制乙炔 | 用电石和饱和食盐水反应,将产生的气体再通入到硫酸铜溶液中除杂 |
| B | 检验溴乙烷在氢氧化钠溶液中是否发生水解 | 将溴乙烷和氢氧化钠溶液共热.冷却后,取上层清液,用稀硝酸酸化,再加硝酸银溶液,观察是否产生淡黄色沉淀 |
| C | 除去乙烷中的乙烯气体 | 将混合气体通入到装有高锰酸钾溶液的洗气瓶中 |
| D | 验证氢氧化铁的溶解度小于氢氧化镁 | 将氯化铁溶液加入到氢氧化镁悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置,验证CO2的性质.
利用如图装置,验证CO2的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H6O、CH3Cl | B. | C100H202、C6H6、C2H2 | ||
| C. | H2O2、CH4、C2H6 | D. | C2H4、CH4、C6H5NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内壁沾有水滴没有烘干就进行配制 | |
| B. | 转移液体时有少量洒落 | |
| C. | 量取浓硫酸时仰视刻度线 | |
| D. | 定容摇匀后液面下降再加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有③④ | C. | 只有①③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | K2SO3粉末 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com