
【题目】现有25mL2mol·L-1的Na2CO3溶液和75mL1mol·L-1的稀盐酸。(1)将Na2CO3溶液逐滴入稀盐酸中;(2)将稀盐酸逐滴滴入Na2CO3溶液中。两操作的现象及结果(标准状况下)为
A.现象相同,所得气体的体积相等B.现象不同,所得气体的体积不等
C.现象不同,所得气体的体积相等D.现象相同,所得气体的体积不等
【答案】B
【解析】
碳酸钠的物质的量为0.025L×2mol/L=0.05mol,HCl的物质的量为0.075L×1mol/L=0.075mol。
向![]() 溶液中逐滴滴入盐酸,发生分步反应:
溶液中逐滴滴入盐酸,发生分步反应:
![]() ,
,![]() ;
;
0.05mol碳酸钠消耗0.05molHCl,生成0.05molNaHCO3,剩余的0.025molHCl和生成的NaHCO3反应生成CO20.025mol,所以开始没有气体产生,后来才有气体生成。
把![]() 溶液逐滴加到盐酸中,开始时盐酸过量,则发生反应
溶液逐滴加到盐酸中,开始时盐酸过量,则发生反应![]() ,开始就有气体放出。0.075molHCl完全反应,消耗0.0375molNa2CO3,生成0.0375molCO2。故反应现象不同,气体体积不等,故选B。
,开始就有气体放出。0.075molHCl完全反应,消耗0.0375molNa2CO3,生成0.0375molCO2。故反应现象不同,气体体积不等,故选B。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入![]() 溶液,所加NaOH溶液的体积
溶液,所加NaOH溶液的体积![]() 与产生沉淀的物质的量
与产生沉淀的物质的量![]() 关系如下图所示,下列说法不正确的是
关系如下图所示,下列说法不正确的是 ![]()
![]()
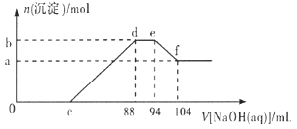
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应溶液的体积为![]()
C.b点与a点的差值为![]()
D.样品中铝粉和铁粉的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是( )
A. 生成的乙酸乙酯中含有18OB. 生成的水分子中含有18O
C. 可能生成44 g乙酸乙酯D. 不可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol![]() L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是
L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中有:2c(Na+)=3c(A2-)+3c(HA-)+3c(HA)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是( )
A.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B.取50mL 0.55mol/L NaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
C.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D.已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O2比O3稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在探究电化学原理时,如图将盐桥换成n型弯铁丝,当接通直流电源后,石墨①附近溶液变红.下列判断或预测错误的是
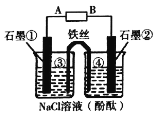
A.A为电源的负极
B.铁丝左端③附近出现灰绿色沉淀
C.电子移动方向为:A→石墨①→铁丝→石墨②→B
D.石墨棒②电极反应式为2Cl—-2e—=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 Y 能用于高性能光学树脂的合成,可由化合物 X 与 2 甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物 X、Y 的说法正确的是( )
A.X 分子中所有原子一定在同一平面上B.Y 物质中含有四种官能团,且能发生加聚反应
C.X→Y 的反应为取代反应D.X、Y 均不能使酸性 KMnO4 溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分是甲烷,它是一种重要的化工原料。
(1)CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH
已知:反应1:CH4(g)=C(s)+2H2(g) ΔH1=+75kJ/mol
反应2: 2CO(g)=C(s)+CO2(g) ΔH2=-172kJ/mol 则该催化反应的ΔH=__________kJ/mol。
(2)工业上可用CO和H2合成二甲醚,其反应为: 2CO(g)+4H2 (g)=CH3OCH3 (g)+H2O(g) ΔH=-204.7 kJ/mol 初始条件相同时,分别在A(恒温)、B(绝热)两个容器内反应。反应初始时两容器的反应速率A_______B(填“>”、“<”或“=”,下同);平衡时CO的转化率A_______B。
(3)工业上可用CO和H2合成甲醇,其反应为CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·md。温度T时,在容积为2L的某密闭容器中进行上述反应,反应过程中相关数据如图所示。
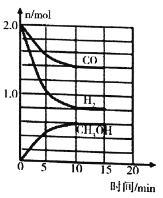
①下列能表明该反应已达到平衡状态的是__________。
a v(H2)=2v(CH3OH) b c( CO)/c( CH3OH)=7: 3时
c c(H2)/c( CH3OH)=2: 1时 d 容器中气体的压强不再变化
②该化学反应10min内生成CH3OH的反应速率v(CH3OH)= __________。
③该温度下,反应的平衡常数为__________ (列出计算式即可) 。
④若其他条件不变时,15mim时再向容器中加入2 mol CO和 x mol H2,平衡时CO的转化率与原平衡相同,则x=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
C.将Ca(HCO3)2溶液与少量Ca(OH)2溶液混合:OH+Ca2++HCO=CaCO3↓+H2O
D.往苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O
+CO2+H2O![]() 2
2![]() +CO
+CO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com