
| A、①④③② | B、④③②① |
| C、②③④① | D、④①②③ |
| m |
| M |
| V |
| Vm |
| N |
| NA |
| N |
| NA |
| 22.4L |
| 22.4L/mol |
| 10g |
| 18g/mol |
| 10 |
| 18 |
| 10 |
| 6 |


科目:高中化学 来源: 题型:
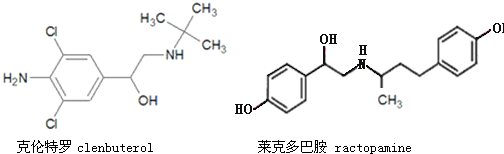
| A、克伦特罗分子的分子式为C12H18ON2Cl2 |
| B、克伦特罗能发生加成、氧化、消去等反应 |
| C、克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别 |
| D、莱克多巴胺与足量NaOH反应,生成物的化学式为C18H20NO3Na3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ |
| B、AlO2- |
| C、Al3+ |
| D、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属氧化物均属于酸性氧化物 |
| B、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| C、根据电解质的水溶液导电性的强弱,将电解质分为强电解质和弱电解质 |
| D、根据反应物和生成物的类别以及反应前后物质种类的多少,把化学反应分为化合反应、分解反应、置换反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol CH4的质量为16g |
| B、常温常压下,1mol任何气体的体积均为22.4L |
| C、H2SO4的摩尔质量为98g/mol |
| D、6.02×1023个SO2分子的质量为64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 | B、氯化钠 |
| C、碳酸氢钠 | D、高锰酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol的NaOH溶于1L水中形成的溶液 |
| B、2molNaOH溶于水配成1L的溶液 |
| C、每2升溶液中含有1mol NaOH |
| D、每2L溶液中含有2mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com