
 .
.分析 A、B、C、D、E、F为原子序数依次增大的同周期元素,D元素原子的次外层电子数比最外层电子数多4个,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;元素均处于第三周期,E元素原子最外层与最内层电子数的差是3,最外层电子数为3+2=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,为氢氧化铝、强碱、强酸之间的反应,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,据此解答.
解答 解:A、B、C、D、E、F为原子序数依次增大的同周期元素,D元素原子的次外层电子数比最外层电子数多4个,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;元素均处于第三周期,E元素原子最外层与最内层电子数的差是3,最外层电子数为3+2=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,为氢氧化铝、强碱、强酸之间的反应,则A为Na、C为Al,三种原子最外层共有11个电子,则F的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg.
(1)由上述分析可知,A为Na、C为Al、D为Si、E为P,
故答案为:Na;Al;Si;P;
(2)B和F形成化合物为MgCl2,用电子式表示形成过程为: ,
,
故答案为: ;
;
(3)D为Si,在周期表中的位置:第三周期ⅣA族,E的氢化物为HCl,化学键类型是共价键,非金属性P>Si,故氢化物的稳定性:PH3>SiH4,
故答案为:第三周期ⅣA族;共价键;PH3>SiH4;
(4)C、F两种元素最高价氧化物的水化物分别为Al(OH)3、HClO4,相互反应的化学方程式:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,
故答案为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,熟练掌握核外电子排布规律与元素化合物性质,注意基础知识的理解掌握.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl->F->Na+>Al3+ | B. | 原子半径:Na>P>O>F | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 金属性:Rb>K>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 原子半径:①>②>③ | ||
| C. | 电负性:③>②>① | D. | 第一电离能:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
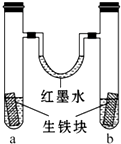 如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )
如图装置中,U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化铵溶液,各加入生铁(含C、Fe)块,a、b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间.下列有关描述错误的是( )| A. | 生铁块中的碳是原电池的正极 | |
| B. | 红墨水柱两边的液面变为左低右高 | |
| C. | 两试管中相同的电极反应式是:Fe-2e-═Fe2+ | |
| D. | a试管中O2得电子,b试管中H+ 得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫能预测钋在地球上的分布 | B. | 钋在第七周期第ⅥA族 | ||
| C. | 钋的最外层电子数为6 | D. | 钋属于副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ•mol-1,则含20.0g溶质的NaOH稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钢铁发生电化学腐蚀时,负极反应都是Fe-3e-=Fe3+ | |
| B. | 镀锡的铁制品,若发生镀层破损,铁制品比受损前更容易锈蚀 | |
| C. | 铜的金属活动性比铁弱,可在海轮外壳上装上铜块以减缓船体腐蚀 | |
| D. | 钢铁发生吸氧腐蚀时,正极反应是:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子188O | B. | 乙烯的结构简式为:C2H4 | ||
| C. | CH4分子的比例模型: | D. | CO2的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com