
”¾ĢāÄæ”æ»ÆѧŠ”×éĢ½¾æĶÓėĻõĖį·“Ó¦µÄæģĀż¼°²śĪļ”£
(1)ŹµŃé¼×£ŗ½«Ķʬ·ÅČėŹ¢ÓŠĻ”HNO3µÄŹŌ¹ÜÖŠ£¬æŖŹ¼ĪŽĆ÷ĻŌĻÖĻó£¬ŗóÖš½„ÓŠŠ”ĘųÅŻÉś³É£¬øĆĘųĢåŹĒ______”£ŌŚŅŗĆęÉĻ·½³öĻÖĒ³ŗģ×ŲÉ«ĘųĢ壬ČÜŅŗ³ŹĄ¶É«”£
(2)ŹµŃéŅŅ£ŗĶÓėÅØHNO3·“Ó¦£¬×°ÖĆ”¢ĻÖĻóČēĻĀ£ŗ
ŹµŃé×°ÖĆ | ŹµŃéĻÖĻó |
| AÖŠ£ŗ×ī³õ·“Ó¦½ĻĀż£¬Ėęŗó¼Óæģ£¬·“Ó¦¾ēĮŅ£»²śÉśŗģ×ŲÉ«ĘųĢ壻ČÜŅŗ³ŹĀĢÉ«”£ BÖŠ£ŗČÜŅŗ³ŹµĄ¶É«”£ |
¢ŁAÖŠĶÓėÅØHNO3²śÉśŗģ×ŲÉ«ĘųĢåµÄ»Æѧ·½³ĢŹ½ŹĒ ______”£
¢ŚŹµŃéĻÖĻó”°×ī³õ·“Ó¦½ĻĀż£¬Ėęŗó¼Óæģ”±µÄŌŅņæÉÄÜŹĒ ______”£
(3)ÓŠĪÄĻ×¼ĒŌŲ£ŗĶÓėÅØHNO3·“Ó¦Ņ»µ©·¢Éś¾Ķ±äæģ£¬ŹĒŅņĪŖæŖŹ¼Éś³ÉµÄNO2ČÜÓŚĖ®ŠĪ³ÉHNO2(ČõĖį£¬²»ĪȶØ)£¬ĖüŌŁŗĶCu·“Ó¦£¬·“Ó¦¾Ķ¼Óæģ”£ŹµŃéĢ½¾æČēĻĀ£ŗ
I£ŗĻņ 1 mLÅØĻõĖįÖŠ¼ÓČė¼øµĪ30% H2O2ČÜŅŗ”¢Ķʬ£¬·“Ó¦½ĻĀż£¬ČÜŅŗ³ŹĄ¶É«”£
II£ŗĻņ1 mLÅØĻõĖįÖŠ¼ÓČė¼øµĪ30% H2O2ČÜŅŗ£¬ĪŽĆ÷ĻŌ±ä»Æ”£
¢ŁIÖŠ·“Ó¦±äĀżµÄŌŅņŹĒ ______”£
¢ŚNO2ÓėH2O·“Ӧɜ³ÉHNO2ŗĶ ______”£
¢Ū¶ŌÉś³ÉHNO2ŗó·“Ó¦±äæģµÄŌŅņ½ųŠŠŹµŃéĢ½¾æ”£
ŠņŗÅ | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó |
III | Č”BÖŠČÜŅŗ£¬¼ÓČėŅ»¶ØĮæ¹ĢĢ壬ŌŁ¼ÓČėĶʬ | Į¢¼“²śÉśĪŽÉ«ĘųĢ壻ŅŗĆęÉĻ·½³Źŗģ×ŲÉ« |
IV | Č”BÖŠČÜŅŗ£¬·ÅÖĆŅ»¶ĪŹ±¼ä£¬ČÜŅŗ±äĪŖĪŽÉ«ŗó£¬ŌŁ¼ÓČėĶʬ | ²śÉśĪŽÉ«ĘųĢ壬½Ļ¢óĀż£»ŅŗĆęÉĻ·½³ŹĒ³ŗģ×ŲÉ« |
a£®IIIÖŠ¼ÓČėµÄ¹ĢĢåĪŖ______”£
b£®IVÖŠ”°·ÅÖĆŅ»¶ĪŹ±¼ä”±µÄÄæµÄŹĒ ______”£
ŹµŃéIII”¢IVæÉŅŌĖµĆ÷£¬HNO2Ńõ»ÆCuµÄ·“Ó¦ĖŁĀŹ±ČHNO3Ńõ»ÆCuµÄ·“Ó¦æģ”£
(4)»ÆѧŠ”×éĶ¬Ń§½įŗĻŹµŃé¼×”¢ŅŅÖŠHNO3±»»¹ŌŗóµÄĘųĢå²śĪļŅŌ¼°ŹµŃéIIIµÄ²śĪļ£¬×ŪŗĻÉĻŹöŹµŃ飬·ÖĪöÅŠ¶Ļ¼×ÖŠ·“Ó¦ĀżµÄŌŅņ£¬³żĮĖĻõĖįĘšŹ¼ÅØ¶ČŠ””¢·“Ó¦¹ż³ĢÖŠĪĀ¶Č½ĻµĶĶā£¬ĮķŅ»øöÖŲŅŖŌŅņŹĒ ______”£
”¾“š°ø”æNO Cu+4HNO3(ÅØ)=Cu(NO3)2+2NO2”ü+2H2O ·“Ó¦·ÅČČ£¬Ėę×Å·“Ó¦µÄ½ųŠŠ£¬ĢåĻµĪĀ¶ČÉżøß H2O2ÓėHNO2·¢Éś·“Ó¦Ź¹HNO2ÅØ¶Č½µµĶ HNO3 NaNO2 Ź¹HNO2ĶźČ«·Ö½ā Ļ”ĻõĖį²»Äܽ«NOŃõ»ÆĪŖNO2£¬ĢåĻµÖŠ²»ÄÜ·¢ÉśNO2ÓėH2OÉś³ÉHNO2µÄ·“Ó¦
”¾½āĪö”æ
(1)CuÓėĻ”ĻõĖį·“Ӧɜ³ÉCu(NO3)2”¢NOŗĶĖ®£¬NOÓėO2·“Ó¦²śÉśŗģ×ŲÉ«NO2£»
(2)CuÓėÅØĻõĖį·“Ӧɜ³ÉĻõĖįĶ”¢NO2ŗĶĖ®£¬øł¾Ż·“Ó¦·ÅČČ¼°ČÜŅŗÅØ¶Č±ä»Æ·ÖĪö·“Ó¦ĖŁĀŹµÄ±ä»Æ£»
(3)¢Łøł¾ŻHNO2ÅØ¶Č“óŠ”¶Ō·“Ó¦ĖŁĀŹµÄÓ°Ļģ·ÖĪö£»
¢Śøł¾ŻŃõ»Æ»¹Ō·“Ó¦¹ęĀÉÅŠ¶Ļ£»
¢Ū¼ÓČėµÄĪļÖŹæÉŅŌÓėČÜŅŗÖŠH+·“Ó¦²śÉśHNO2¼“æÉ£»øł¾ŻHNO2µÄ²»ĪČ¶ØŠŌ¼°ĘäÅØ¶ČµÄÓ°Ļģ·ÖĪö·ÅÖĆŅ»¶ĪŹ±¼äµÄ·“Ó¦ĻÖĻó£»
(4)øł¾ŻÄÜ·ń²śÉśHNO2¼°HNO2µÄĒæŃõ»ÆŠŌ·ÖĪöÅŠ¶Ļ”£
(1)CuÓėĻ”ĻõĖį·“Ӧɜ³ÉCu(NO3)2”¢NOŗĶH2O£¬ĪŽÉ«ĘųĢåÓöæÕĘų±äĪŖŗģ×ŲÉ«£¬ĖµĆ÷øĆĪŽÉ«ĘųĢåŹĒNO£¬ŌŚŹŅĪĀĻĀNOÓėO2·“Ó¦²śÉśŗģ×ŲÉ«NO2£»
(2)¢ŁCuÓėÅØĻõĖį·“Ӧɜ³ÉCu(NO3)2”¢NO2ŗĶH2O£¬øł¾ŻŌ×ÓŹŲŗć”¢µē×ÓŹŲŗć£¬æɵĆøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗCu+4HNO3(ÅØ)=Cu(NO3)2+2NO2”ü+2H2O
¢ŚøĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬Ėę×Å·“Ó¦µÄ½ųŠŠ£¬ČÜŅŗĪĀ¶ČÉżøߣ¬Ņņ“ĖŅ»µ©·¢Éś·“Ó¦ĖŁĀŹ¾Ķ±äæģ£¬ŗóµ±·“Ó¦Ņ»¶ĪŹ±¼ä£¬ĻõĖįÅØ¶Č½µµĶ£¬ČÜŅŗÅØ¶Č¶ŌĖŁĀŹµÄÓ°ĻģÕ¼ÓÅŹĘ£¬ČÜŅŗÅØ¶Č½µµĶ£¬·“Ó¦ĖŁĀŹÓÖÖš½„¼õŠ”£»
(3)¢ŁIÖŠ·“Ó¦±äĀżŹĒÓÉÓŚH2O2ÓėHNO2·¢Éś·“Ó¦Ź¹HNO2ÅØ¶Č½µµĶ£¬µ¼ÖĀĖŁĀŹ¼õĀż£»
¢ŚNO2ÖŠNŹĒ+4¼Ū£¬NO2ÓėH2O·“Ӧɜ³ÉHNO2ÖŠNŹĒ+3¼Ū£¬»ÆŗĻ¼Ū½µµĶ£¬øł¾ŻŃõ»Æ»¹Ō·“Ó¦¹żĮ棬±ŲČ»Ķ¬Ź±ÓŠŌŖĖŲ»ÆŗĻ¼ŪÉżøߣ¬øł¾Żø÷ÖÖŌŖĖŲ»ÆŗĻ¼ŪĢŲµć£¬»¹²śÉśĮĖ+5¼ŪµÄHNO3£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ2NO2+H2O=HNO2+HNO3£»
¢Ūa.ŌŚBČÜŅŗÖŠŗ¬ÓŠNO2ÓėH2O·“Ó¦²śÉśµÄHNO2”¢HNO3£¬HNO3ŹĒĒæĖį£¬ĶźČ«µēĄė£¬¶ųHNO2ŹĒČõĖį£¬ŌŚČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£¬ĻņŹµŃéIIIµÄBČÜŅŗÖŠ¼ÓČėµÄ¹ĢĢåŗóŅŖ·“Ó¦²śÉśHNO2£¬Ź¹HNO2ÅضČŌö“ó£¬Ōņ¼ÓČėµÄĪļÖŹŗ¬ÓŠNO2-£¬æÉŅŌŹĒNaNO2”¢KNO2µČ£¬HNO3ÓėNaNO2·¢Éśø“·Ö½ā·“Ó¦²śÉśHNO2£¬Ź¹ČÜŅŗÖŠHNO2ÅضČŌö“ó£¬ŌŁ¼ÓČėCuŗóæģĖŁ·“Ó¦£¬Cu±»Ńõ»Æ²śÉśCu(NO3)2£»
b. HNO2²»ĪČ¶Ø£¬»į·¢Éś·Ö½ā·“Ó¦£¬ŌŚIVÖŠ”°·ÅÖĆŅ»¶ĪŹ±¼ä”±µÄÄæµÄŹĒŹ¹HNO2ĶźČ«·Ö½ā£»
(4)·ÖĪöÅŠ¶Ļ¼×ÖŠ·“Ó¦ĀżµÄŌŅņ£¬³żĮĖĻõĖįĘšŹ¼ÅØ¶ČŠ””¢·“Ó¦¹ż³ĢÖŠĪĀ¶Č½ĻµĶĶā£¬»¹ÓŠĮķŅ»øöÖŲŅŖŌŅņ¾ĶŹĒĻ”ĻõĖįŃõ»ÆŠŌČõ£¬²»Äܽ«NOŃõ»ÆĪŖNO2£¬ŌŚ·“Ó¦ĢåĻµÖŠ²»ÄÜ·¢ÉśNO2ÓėH2OÉś³ÉHNO2µÄ·“Ó¦”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ800”ꏱ£¬ČżøöĻąĶ¬µÄŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦CO(g) + H2O(g)![]() CO2(g) + H2(g) K£¬Ņ»¶ĪŹ±¼äŗ󣬷ֱš“ļµ½»ÆŃ§Ę½ŗāדĢ¬”£
CO2(g) + H2(g) K£¬Ņ»¶ĪŹ±¼äŗ󣬷ֱš“ļµ½»ÆŃ§Ę½ŗāדĢ¬”£
ČŻĘ÷±ąŗÅ | ĘšŹ¼ÅضČ/(mol”¤L1) | |||
c(CO) | c(H2O) | c(CO2) | c(H2) | |
¢ń | 0.01 | 0.01 | 0 | 0 |
¢ņ | 0 | 0 | 0.01 | 0.01 |
III | 0.008 | 0.008 | 0.002 | 0.002 |
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A.¢ņ ÖŠ“ļĘ½ŗāŹ±£¬c(H2)£½0.005 mol”¤L1
B.IIIÖŠ“ļĘ½ŗāŹ±£¬COµÄĢå»ż·ÖŹż“óÓŚ25%
C.IIIÖŠ“ļµ½Ę½ŗāדĢ¬ĖłŠčµÄŹ±¼ä±Č ¢ń ÖŠµÄ¶Ģ
D.ČōIIIÖŠĘšŹ¼ÅØ¶Č¾łŌö¼ÓŅ»±¶£¬Ę½ŗāŹ±c(H2)ŅąŌö¼ÓŅ»±¶
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÕĘĪÕŅĒĘ÷Ćū³Ę”¢×é×°¼°Ź¹ÓĆ·½·ØŹĒ֊ѧ»ÆѧŹµŃéµÄ»ł“”£¬ČēĶ¼ĪŖÕōĮóŹµŃé×°ÖĆ”£
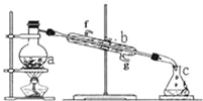
£Ø1£©Š“³öĻĀĮŠŅĒĘ÷µÄĆū³Ę£ŗa£®__b£®__”£
£Ø2£©ŹµŃé¹ż³ĢÖŠ£¬ŠčŅŖĶØĄäĖ®£¬Ķ¼ÖŠµÄ½ųĖ®·½ĻņŹĒ__½ų£ØĢīĶ¼ÖŠ×ÖÄø£©”£
£Ø3£©ČōĄūÓĆ×°ÖĆ·ÖĄėĖÄĀČ»ÆĢ¼ŗĶ¾Ę¾«µÄ»ģŗĻĪļ£¬»¹Č±ÉŁµÄÓĆĘ·ŹĒ__”£
£Ø4£©ČōÓĆ×°ÖĆÖĘÕōĮóĖ®£¬ŹµŃ鏱aÖŠ³ż¼ÓČėÉŁĮæ×ŌĄ“Ė®Ķā£¬»¹Šč¼ÓČėÉŁĮæ__£¬Ęä×÷ÓĆŹĒ·ĄÖ¹±©·Š”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫0.1mol MnO2¼Óµ½10mL¹żŃõ»ÆĒā£ØH2O2£©µÄĖ®ČÜŅŗĄļ£ØĆܶČĪŖ1.1g/mL£©£¬ŌŚ±ź×¼×“æöĻĀ·Å³öĘųĢåµÄĢå»żŗĶŹ±¼äµÄ¹ŲĻµČēĶ¼£ŗ
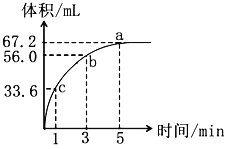
£Ø1£©a”¢b”¢cČżµć·“Ó¦ĖŁĀŹæģĀżĖ³ŠņĪŖ_______£¬·“Ó¦ĖŁĀŹ±ä»ÆµÄæÉÄÜŌŅņŹĒ______________”£
£Ø2£©¼ĘĖć¹żŃõ»ÆĒāµÄĘšŹ¼ĪļÖŹµÄĮæÅØ¶ČŹĒ¶ąÉŁ£æ_______________
£Ø3£©¼ŁÉč·“Ó¦¹ż³ĢÖŠČÜŅŗµÄĢå»ż±£³Ö²»±ä£¬ŌņÓĆH2O2±ķŹ¾øĆ·“Ó¦1”Ŗ3·ÖÖÓÄŚµÄĘ½¾łĖŁĀŹĪŖ¶ąÉŁ£æ_________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹ŲÓŚÅØ¶Č¾łĪŖ0.1 mol/LµÄČżÖÖČÜŅŗ£ŗ¢Ł°±Ė®”¢¢ŚŃĪĖį”¢¢ŪĀČ»Æļ§ČÜŅŗ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. c£ØNH+4£©£ŗ¢Ū£¾¢ŁB. Ė®µēĄė³öµÄc£ØH+£©£ŗ¢Ś£¾¢ŁC. ¢ŁŗĶ¢ŚµČĢå»ż»ģŗĻŗóµÄČÜŅŗ£ŗc£ØH+£©£½c(OH![]() )+c(NH3”¤H2O) D. ¢ŁŗĶ¢ŪµČĢå»ż»ģŗĻŗóµÄČÜŅŗ£ŗc£ØNH+4£©£¾c(Cl
)+c(NH3”¤H2O) D. ¢ŁŗĶ¢ŪµČĢå»ż»ģŗĻŗóµÄČÜŅŗ£ŗc£ØNH+4£©£¾c(Cl![]() )£¾c(OH
)£¾c(OH![]() )£¾c(H+)
)£¾c(H+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“×Ėį”¢ŃĪĖįŗĶĢ¼ĖįÄĘŹĒÉś»īÖŠ³£¼ūµÄĪļÖŹ”£
£Ø1£©Ģ¼ĖįÄĘĖ®ČÜŅŗĻŌ¼īŠŌµÄŌŅņŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©______”£
£Ø2£©25”ꏱ£¬Ģå»żĻąĶ¬£¬ÅØ¶Č¾łĪŖ0.1mol”¤L-1µÄŃĪĖįŗĶ“×ĖįČÜŅŗ£¬ĻĀĮŠĖµ·ØÕżČ·ŹĒ_____”£
a£®Į½ČÜŅŗµÄpHĻąĶ¬
b£®Į½ČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(OH-)ĻąĶ¬
c£®Į½ČÜŅŗ·Ö±šÓė×ćĮæµÄ½šŹōMg·“Ó¦£¬²śÉśµÄH2Ģå»żĻąĶ¬
d£®Į½ČÜŅŗÖŠ·Ö±š¼ÓČėNaOHÖĮÖŠŠŌ£¬ĻūŗÄNaOHĪļÖŹµÄĮæĻąĶ¬
£Ø3£©25”ꏱ£¬pH¾łµČÓŚ4µÄ“×ĖįČÜŅŗŗĶĀČ»Æļ§ČÜŅŗ£¬“×ĖįČÜŅŗÖŠĖ®µēĄė³öµÄH£«ÅضČÓėĀČ»Æļ§ČÜŅŗÖŠĖ®µēĄė³öµÄH£«ÅضČÖ®±ČŹĒ______”£
£Ø4£©“×ĖįČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£ŗCH3COOH![]() CH3COO££«H£«£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ___”£
CH3COO££«H£«£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ___”£
a£®CH3COOHČÜŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµĀś×ć£ŗc(H£«)£½c(OH£)£«c(CH3COO)
b£®0.1mol”¤L-1µÄCH3COOH ČÜŅŗ¼ÓĖ®Ļ”ŹĶ£¬ČÜŅŗÖŠc(OH”„)¼õŠ”
c£®CH3COOHČÜŅŗÖŠ¼ÓČėÉŁĮæCH3COONa¹ĢĢå£¬Ę½ŗāÄęĻņŅʶÆ
d£®³£ĪĀĻĀ£¬pH£½2µÄCH3COOHČÜŅŗÓėpH£½12µÄNaOHČÜŅŗµČĢå»ż»ģŗĻŗóČÜŅŗµÄpH£¾7
e£®ŹŅĪĀĻĀpH=3µÄ“×ĖįČÜŅŗ¼ÓĖ®Ļ”ŹĶ£¬ČÜŅŗÖŠ![]() ²»±ä
²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¹ŲÓŚÓŠ»śĪļa( )”¢b(
)Ӣb(![]() )Ӣc(
)”¢c( )µÄĖµ·Ø“ķĪóµÄŹĒ
)µÄĖµ·Ø“ķĪóµÄŹĒ
A. a”¢b”¢c»„ĪŖĶ¬·ÖŅģ¹¹Ģå
B. a”¢c¾łÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«
C. a”¢cÓė×ćĮæĒāĘų·“Ó¦ĻūŗÄĒāĘųµÄĪļÖŹµÄĮæÖ®±ČŹĒ4”Ć3
D. a”¢b”¢cµÄŅ»ĀČ“śĪļ·Ö±šÓŠ4ÖÖ”¢1ÖÖ”¢2ÖÖ(²»æ¼ĀĒĮ¢ĢåŅģ¹¹)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ūĻ©ŹĒÖŲŅŖµÄÓŠ»ś»Æ¹¤ŌĮĻ£¬±ūĶéĶŃĒāÖʱūĻ©¾ßÓŠĻŌÖųµÄ¾¼Ć¼ŪÖµŗĶÉē»įŅāŅ唣»Ų“šĻĀĮŠĪŹĢā”£
£Ø1£©ŅŃÖŖ£ŗI.2C3H8(g)+O2(g)=2C3H6(g)+2H2O(g) ¦¤H=-238kJ”¤mol-1
II.2H2(g)+O2(g)=2H2O(g) ¦¤H=-484kJ”¤mol-1
Ōņ±ūĶéĶŃĒāÖʱūĻ©·“Ó¦C3H8(g)![]() C3H6(g)+H2(g)µÄ¦¤HĪŖ___”£
C3H6(g)+H2(g)µÄ¦¤HĪŖ___”£
£Ø2£©ČēĶ¼ĪŖ±ūĶéÖ±½ÓĶŃĒā·ØÖŠ±ūĶéŗĶ±ūĻ©µÄĘ½ŗāĢå»ż·ÖŹżÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµ(Ķ¼ÖŠµÄŃ¹Ēæ·Ö±šĪŖ104PaŗĶ105Pa)”£
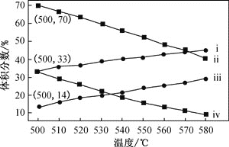
104PaŹ±£¬Ķ¼ÖŠ±ķŹ¾±ūĻ©µÄĒśĻߏĒ__(Ģī”°¢””±”¢”°¢¢”±”¢”°¢£”±»ņ”°¢¤”±)”£
£Ø3£©Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1molC3H8£¬æŖŹ¼Ń¹ĒæĪŖpkPa£¬·¢Éś±ūĶéĶŃĒāÖʱūĻ©·“Ó¦”£
¢ŁĻĀĮŠĒéæöÄÜĖµĆ÷±ūĶéĶŃĒāÖʱūĻ©·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ__(Ģī×ÖÄø)”£
A.øĆ·“Ó¦µÄģŹ±ä(¦¤H)±£³Ö²»±ä
B.ĘųĢåĘ½¾łÄ¦¶ūÖŹĮæ±£³Ö²»±ä
C.ĘųĢåĆܶȱ£³Ö²»±ä
D.C3H8·Ö½āĖŁĀŹÓėC3H6ĻūŗÄĖŁĀŹĻąµČ
¢ŚÓūŹ¹±ūĻ©µÄĘ½ŗā²śĀŹĢįøߣ¬Ó¦²ÉČ”µÄ“ėŹ©ŹĒ__£ØĢī±źŗÅ£©”£
A.ÉżøßĪĀ¶Č B.½µµĶĪĀ¶Č C.Ōö“óŃ¹Ēæ D.½µµĶŃ¹Ēæ
¢ŪĪŖĢį¹©·“Ó¦ĖłŠčČČĮ棬ŗćŃ¹Ź±ČōĻņŌĮĻĘųÖŠ²ōČėĖ®ÕōĘų£¬Ōņ±ūĶéĶŃĒā·“Ó¦µÄK__(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)
£Ø4£©±ūĶéĶŃĒāÖʱūĻ©·“Ó¦¹ż³ĢÖŠ£¬C3H8µÄĘųĢåĢå»ż·ÖŹżÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼aĖłŹ¾”£“ĖĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżKp=__kPa(ÓĆŗ¬×ÖÄøpµÄ“śŹżŹ½±ķŹ¾£¬KpŹĒÓĆ·“Ó¦ĢåĻµÖŠĘųĢåĪļÖŹµÄ·ÖŃ¹±ķŹ¾µÄĘ½ŗā³£Źż£¬Ę½ŗā·ÖŃ¹=×ÜŃ¹”ĮĪļÖŹµÄĮæ·ÖŹż)”£
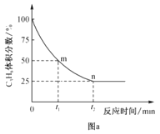
£Ø5£©ĄūÓĆCO2µÄČõŃõ»ÆŠŌ£¬æŖ·¢ĮĖ±ūĶéŃõ»ÆĶŃĒāÖʱūĻ©µÄŠĀ¹¤ŅÕ”£øĆ¹¤ŅÕæɲÉÓĆøõµÄŃõ»ÆĪļĪŖ“߻ƼĮ£¬Ęä·“Ó¦»śĄķČēĶ¼”£
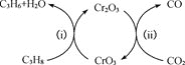
Ķ¼ÖŠ“߻ƼĮĪŖ__”£øĆ¹¤ŅÕæÉŅŌÓŠŠ§Ļū³ż“߻ƼĮ±ķĆęµÄ»żĢ棬Ī¬³Ö“߻ƼĮ»īŠŌ£¬ŌŅņŹĒ__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌĖÓĆ»Æѧ·“Ó¦ŌĄķµÄÓŠ¹ŲÖŖŹ¶»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)¾§Ģå¹čŌŚŃõĘųÖŠČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖSi(s)+O2(g)=SiO2(s)”÷H=-989.2 kJ”¤mol-1£¬ÓŠ¹Ų¼üÄÜŹż¾ŻČēĻĀ±ķ£ŗ
»Æѧ¼ü | Si-O | O=O | Si-Si |
¼üÄÜkJ”¤mol-1 | X | 498.8 | 176 |
ŌņXµÄÖµĪŖ_________”£
(2)¼ÓČČN2O5£¬ŅĄ“Ī·¢ÉśµÄ·Ö½ā·“Ó¦ĪŖ¢ŁN2O5![]() N2O3+O2£¬¢ŚN2O3
N2O3+O2£¬¢ŚN2O3![]() N2O+O2£¬ŌŚ1 LĆܱÕČŻĘ÷ÖŠ³äČė4 mol N2O5£¬¼ÓČȵ½t ”ę£¬“ļµ½Ę½ŗāדĢ¬ŗóO2µÄĘ½ŗāÅضČĪŖ4.5 mol/L£¬N2O3µÄĘ½ŗāÅضČĪŖ1.7 mol/L£¬Ōņt”ꏱ·“Ó¦¢ŁµÄĘ½ŗā³£ŹżĪŖ_________”£
N2O+O2£¬ŌŚ1 LĆܱÕČŻĘ÷ÖŠ³äČė4 mol N2O5£¬¼ÓČȵ½t ”ę£¬“ļµ½Ę½ŗāדĢ¬ŗóO2µÄĘ½ŗāÅضČĪŖ4.5 mol/L£¬N2O3µÄĘ½ŗāÅضČĪŖ1.7 mol/L£¬Ōņt”ꏱ·“Ó¦¢ŁµÄĘ½ŗā³£ŹżĪŖ_________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com