
| A. | Na2SO4→2Na+1+SO4-2 | B. | H2SO4→H2++SO42- | ||
| C. | CaCl2→Ca2++2 Cl- | D. | Mg(OH)2→Mg2++(OH-)2 |
分析 A、Na2SO4电离为Na+和SO42-;
B、硫酸是二元强酸,能电离为2个H+和1个SO42-;
C、CaCl2是盐,能电离出Ca2+和2和Cl-;
D、Mg(OH)2是二元碱,能电离为Mg2+和2个OH-.
解答 解:A、Na2SO4电离为Na+和SO42-,故电离方程式应为:Na2SO4→2Na++SO42-,故A错误;
B、硫酸是二元强酸,能电离为2个H+和1个SO42-,H2SO4→2H++SO42-,故B错误;
C、CaCl2是盐,能电离出Ca2+和2和Cl-,CaCl2→Ca2++2 Cl-,故C正确;
D、Mg(OH)2是二元碱,能电离为Mg2+和2个OH-,Mg(OH)2→Mg2++2OH-,故D错误.
故选C.
点评 本题考查了电离方程式的书写,应注意的是在书写电离方程式时,离子符号书写要正确、原子团不能拆、离子个数的表示要正确,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | c(HX)>c(X-) | B. | c(HX)+c(H+)=c(Na+)+c(OH-) | ||
| C. | c(X-)+c(HX)=2c(Na+) | D. | c(OH-)<c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80 mL | B. | 100 mL | C. | 120 mL | D. | 110 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用铝热剂的反应,常用于冶炼高熔点的金属 | |
| B. | 氧化铝和铁的混合物是铝热剂 | |
| C. | 铝热剂发生的铝热反应需要用镁带和氯酸钾引燃,所以铝热反应是吸热反应 | |
| D. | 工业上常用铝热反应来大量冶炼金属铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
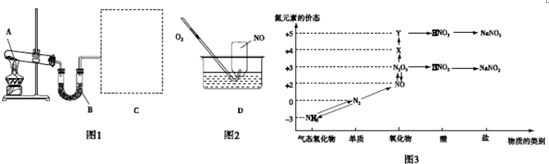
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com