
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3 . 请回答下列问题:
(1)Na3N的电子式是 , 该化合物由键形成.
(2)Na3N与盐酸反应生成种盐,其电子式分别是 , .
(3)Na3N与水的反应属于(填基本反应类型)反应.
(4)比较Na3N中两种粒子的半径:r(Na+)(填“>”“=”“<”) r(N3﹣).
【答案】
(1)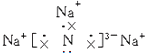 ;离子
;离子
(2)2;![]() ;
;![]()
(3)复分解
(4)<
【解析】解:(1)氮化钠是由钠离子与氮离子通过离子键结合成的离子化合物,电子式为 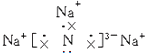 ,所以答案是:
,所以答案是: 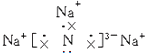 ;离子;
;离子;
(2.)Na3N与盐酸反应生成氯化钠和氯化铵,方程式Na3N+4HCl=3NaCl+NH4Cl,氯化钠为离子化合物,电子式为: ![]() ;氯化铵为离子化合物,电子式:
;氯化铵为离子化合物,电子式: ![]() ;
;
所以答案是:2; ![]() ;
; ![]() ;
;
(3.)Na3N电离出Na+、N3﹣ , H2O电离出H+、OH﹣ , N3﹣和H+结合成为NH3 , Na+与OH﹣结合成为NaOH,氮化钠和水发生了复分解反应,反应的方程式是:Na3N+3H2O=3NaOH+NH3↑,
所以答案是:复分解;
(4.)钠离子与氮离子具有相同的核外电子排布,钠离子质子数多与氮离子,所以钠离子半径小于氮离子,所以答案是:<.


科目:高中化学 来源: 题型:
【题目】下列现象中,能用范德华力解释的是( )
A.氮气的化学性质稳定B.通常状况下,溴呈液态,碘呈固态
C.氢氧化钠的熔点高于氢氧化钾D.锂的熔点比钠高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市环境中的大气污染物主要是
A、 O2、Cl2、HCl 、酸雨
B、 SO2、NO2、CO、烟尘
C、 NH3、CO、CO2、雾
D、 HCl、SO2、N2、粉尘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 摩尔是物质的质量单位 B. 氢气的摩尔质量是2g
C. 1molOH—的质量是17g D. 气体摩尔体积就是1mol气体所占的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是( )
A. pH=7的溶液 B. c(H+)=1.0×10-7mol·L-1的溶液
C. c(H+)=c(OH-)的溶液 D. pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
A.H,D,T互为同素异形体
B.氨分子中的化学键为非极性共价键
C.NH4Cl的电子式: ![]()
D.S2﹣的结构示意图: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W,X,Y,Z在元素周期表中的位置如图所示.下列说法中,正确的是( ) 
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的的氮气和水蒸气,并放出大量的热量.已知0.4mol液态肼和足量双氧水反应生成氮气和水蒸气时放出256.65KJ的热量。
(1)写出肼和过氧化氢的结构式肼_______,过氧化氢_________。
(2)上述反应应用于火箭推进剂,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是______。
(3)写出肼和双氧水反应的热化学方程式___________。
(4)已知H2O(l)═H2O(g);△H=+44KJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是_________。
(5)已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
则肼与NO2完全反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲称取5.5 g食盐晶体。但在操作时将食盐晶体与砝码的位置放颠倒了,则实际称得的食盐晶体的质量为(1 g 以下用游码)
A. 6.5 g B. 6.0 g C. 5.5 g D. 4.5 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com