
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | |
| C. | v(C)=0.4mol/(L•min) | D. | v(D)=0.0075 mol/(L•s) |
| A. | A | B. | B | C. | C | D. | D |
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计量数的比值越大,表示反应速率越快,注意单位保持一致.
解答 解:A.$\frac{v(A)}{1}$=0.15mol/(L•min),
B.$\frac{v(B)}{3}$=0.2mol/(L•min);
C.$\frac{v(C)}{2}$=0.2mol/(L•min)
D.v(D)=0.0075 mol/(L•s)=v(D)=0.45 mol/(L•min),$\frac{v(D)}{2}$=0.225mol/(L•min),
故反应速率v(D)>v(B)=v(C)>v(A),
故选:D.
点评 本题考查化学反应速率快慢比较,难度不大,利用比值法可以迅速判断,也可以转化为同一物质的速率进行比较.


科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 金属单质跟酸反应,一定放出氢气 | |
| C. | 元素从化合态变为游离态时,一定被氧化 | |
| D. | 元素从化合态变为游离态时,一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①④ | C. | ①②③ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C22-的电子式是[ ]2- ]2- | |
| B. | Mg2C3和Li2C2与水反应生成的烃可能具有相同的官能团 | |
| C. | 1mol ZnC2与水反应生成的烃的体积约为22.4L | |
| D. | Al4C3与水反应生成的烃分子中只有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
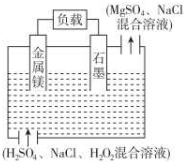 镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )
镁-过氧化氢电池是一种新型的高性能电源,其结构如图所示,下列说法不正确的是( )| A. | 镁作该电源负极,发生反应Mg-2e-═Mg2+ | |
| B. | 该电池反应方程式:Mg+H2O2+2H+═Mg2++2H2O | |
| C. | 放电时溶液中的Cl-向正极移动 | |
| D. | 放电时正极周围溶液的pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Cl2+H2O═HCl+HClO | ||
| C. | Cl2+Cu$\frac{\underline{\;点燃\;}}{\;}$CuCl2 | D. | Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com