
【题目】目前“低碳减排”备受关注,![]() 的产生及有效开发利用成为科学家研究的重要课题。
的产生及有效开发利用成为科学家研究的重要课题。

(1)汽车尾气净化的主要原理为![]() 。在密闭容器中发生该反应时,
。在密闭容器中发生该反应时,![]() 随温度
随温度![]() 、催化剂表面积
、催化剂表面积![]() 和时间
和时间![]() 的变化曲线如图1示。据此判断:
的变化曲线如图1示。据此判断:
①该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
②在![]() 温度下,
温度下,![]() 内的平均反应速率
内的平均反应速率![]() ______
______![]() 。
。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积![]() ,在答题卡相应图中画出
,在答题卡相应图中画出![]() 在
在![]() 、
、![]() 条件下达到平衡过程中的变化曲线_____。
条件下达到平衡过程中的变化曲线_____。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图如图2正确且能说明反应在进行到![]() 时刻达到平衡状态的是______
时刻达到平衡状态的是______![]() 填代号
填代号![]() 。
。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用![]() 催化还原
催化还原![]() 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
例如:![]()
![]()
写出![]() 催化还原
催化还原![]() 生成
生成![]() 、
、![]() 和
和![]() 的热化学方程式:______。
的热化学方程式:______。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图3通过人工光合作用,以![]() 和
和![]() 为原料制备HCOOH和
为原料制备HCOOH和![]() 的原理示意图。催化剂b表面发生的电极反应为______
的原理示意图。催化剂b表面发生的电极反应为______
③常温下![]() 的HCOONa溶液pH为10,则HCOOH的电离常数
的HCOONa溶液pH为10,则HCOOH的电离常数![]() ______
______![]() 填写最终计算结果
填写最终计算结果![]() 。
。
【答案】< 0.025 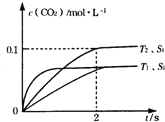 bd
bd ![]()
![]()
![]()
【解析】
(1)①根据“先拐先平”可知T1>T2,再根据温度越高CO2的浓度越低可知,温度升高平衡向逆反应方向移动,则该反应的逆反应吸热,正反应放热,ΔH<0;
②直接根据化学反应速率公式计算,但先要根据化学计量数算出2s时N2的物质的量浓度为0.05mol/L;
③催化剂表面积变小则反应速率减小,但不影响平衡,因此,变化曲线会比原曲线平缓,到达平衡的时间增大,但是平衡时的浓度相同;
④a只是显示了正反应的速率,只有正、逆反应速率相等才说明达到了平衡状态;b中平衡常数会随温度变化而变化,当平衡常数不再发生改变,则说明反应达到平衡状态,正确;c中两者的物质的量虽然相等了,但还处于变化当中,只有物质的量不再改变才能说明达到了平衡状态;d正确,某物质的质量分数不再发生改变,反应就达到平衡状态;
(2)①根据盖斯定律,用上一个反应减下一个反应即可,焓变同减;
②该装置没有外接电源,属于原电池装置。则质子会向正极移动,因此催化剂b极为正极,发生得电子反应;制备的总反应式为2CO2+2H2O=2HCOOH+O2,则得电子的物质为CO2,因此,正极的电极反应式为CO2+2H++2e-=HCOOH;
③根据常温下![]() 的HCOONa溶液pH为10计算甲酸根离子水解常数,然后根据水解常数和电离常数之间关系计算。
的HCOONa溶液pH为10计算甲酸根离子水解常数,然后根据水解常数和电离常数之间关系计算。
(1)①由图1可知,温度![]() 先到达平衡,故温度
先到达平衡,故温度![]() ,温度越高,平衡时二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,故答案为:
,温度越高,平衡时二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,故答案为:![]() ;
;
②由图可知,![]() 温度时2s到达平衡,平衡时二氧化碳的浓度变化量为
温度时2s到达平衡,平衡时二氧化碳的浓度变化量为![]() ,故
,故![]() ,根据化学反应的反应速率之比等于化学计量数之比,故
,根据化学反应的反应速率之比等于化学计量数之比,故![]() ,故答案为:
,故答案为:![]() ;
;
③接触面积越大反应速率越快,达到平衡的时间越短,催化剂的表面积![]() ,
,![]() 条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度
条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度![]() 到达平衡时相同,故
到达平衡时相同,故![]() 在
在![]() 、
、![]() 条件下达到平衡过程中的变化曲线为:
条件下达到平衡过程中的变化曲线为: ,故答案为:
,故答案为: ;
;
④a.到达平衡后正、逆速率相等,不再变化,![]() 时刻v正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
时刻v正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达到最大,平衡常数不变,图象与实际符合,故b正确;
c.t1时刻后![]() 、NO的物质的量发生变化,所以
、NO的物质的量发生变化,所以![]() 时刻未到达平衡状态,故c错误;
时刻未到达平衡状态,故c错误;
d.t1时刻NO的质量分数不变,处于平衡状态,故d正确;
故答案为:bd;
(2)①CH4还原![]() 生成
生成![]() 、
、![]() 和
和![]() 的方程式为
的方程式为![]() ,所以将已知两方程式相减有
,所以将已知两方程式相减有![]()
![]()
![]() ;反应的热化学方程式为
;反应的热化学方程式为![]()
![]() ,故答案为:
,故答案为:![]()
![]() ;
;
②酸性条件下,![]() ,即
,即![]() 得电子发生还原反应,根据守恒规律写出电极反应式为
得电子发生还原反应,根据守恒规律写出电极反应式为![]() ,故答案为:
,故答案为:![]() ;
;
③![]() 的HCOONa溶液pH为10,则
的HCOONa溶液pH为10,则![]() 的
的![]() 水解生成
水解生成![]() ,
,![]() 水解
水解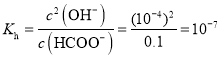 ,再根据
,再根据![]() ,故答案为:
,故答案为:![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】为了检验在氢气和二氧化碳的混合气体中是否混入了一氧化碳,用如下的装置进行实验。请回答:
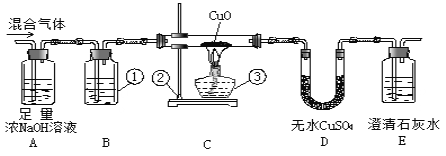
(1)写出标有番号的仪器名称:①___________,②_____________,③_____________。
(2)装置B中用的试剂是 _______________,目的是为了_______________________。
(3)当观察到E装置中出现____________现象时,说明混合气体中一定含有一氧化碳。
(4)如果混合气体中含有一氧化碳,为了保护环境,应在E装置右边的排气管口采取的措施是_____。
(5)A装置的作用是___________,反应的化学方程式是___________________。
(6)假设混合气体中的CO与CuO完全反应,当通入的气体为mg, D增重ng,E瓶增重pg。则混合气体中CO的质量百分数为:_________%;如果去掉D装置,这里计算的CO的质量百分数准确吗?为什么?___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。右图是某同学用0.1molL-1KOH溶液分别滴定体积均为20mL、浓度均为0.1molL-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是

A.曲线①代表0.1 molL-1 KOH溶液滴定CH3COOH溶液的滴定曲线
B.在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05 molL-1
C.在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
D.在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
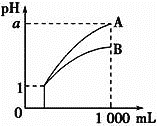
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。回答下列问题(相关数据如下):
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
ⅡA元素氢氧化物 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | ||||
25℃时饱和溶液浓度molL-1 | 8.00×10-6 | 5.00×10-4 | 2.00×10-2 | 6.00×10-2 | 2.00×10-1 | ||||
I.(1)SrO2中氧元素的化合价为___。Sr(OH)2的碱性比Mg(
(2)工业上可以用SrO与铝粉充分混合,在真空加热反应生成金属锶和3SrO8Al2O3,写出该反应的化学方程式___。
Ⅱ.以天青石(主要含有SrSO4和少量CaCO3杂质)生产Sr(OH)2xH2O的工艺如下:
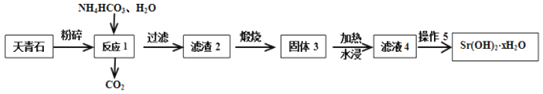
(3)滤渣2为混有CaCO3的SrCO3,写出生成SrCO3的化学方程式___。
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2涪液,此时应缓慢加热使沉淀颗粒长大,有利于___。
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤、洗涤、干燥。为得到较大颗粒的Sr(OH)2xH2O晶体,可采用的方法是___(填一种)。
(6)取m g纯净Sr(OH)2xH2O产品溶于水,加入过量纯碱溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=___(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。

(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/L NH4HCO3 溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
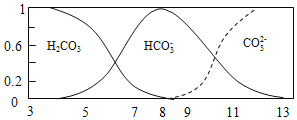
A. 常温下,Kb(NH3H2O)>Ka1(H2CO3)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11 时,随着pH值的增大,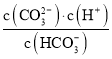 增大
增大
D. pH=3时,有c(NH4+)+c(NH3H2O)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | N(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() molL-1min
molL-1min
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com