
【题目】NH3极易溶于水,可用作喷泉试验。回答下列问题:
(l)实验室制取NH3通常有两种方法:i用固体氢氧化钙与氯化铵共热;ii在常温下用固体氢氧化钠与浓氨水混合。
①方法i制取氨气的化学方程式为 ___。
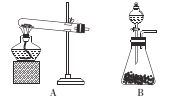
②方法ii应选用的发生装置是 ___(填“A”或“B”),生成NH3的原因是____
(2)进行如图所示喷泉实验时,上部烧瓶中已充满干燥的NH3,引发喷泉的操作是____;若在烧杯内的水中滴加几滴无色酚酞试液,则形成喷泉后,烧瓶里的溶液呈____色。

【答案】2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O B 氢氧化钠固体溶于水时,放出大量的热,使浓氨水中的NH3·H2O分解产生氨气,同时增大了OH-浓度,使平衡NH3·H2O
CaCl2 + 2NH3↑+2H2O B 氢氧化钠固体溶于水时,放出大量的热,使浓氨水中的NH3·H2O分解产生氨气,同时增大了OH-浓度,使平衡NH3·H2O![]() NH4++OH-逆向移动,使NH3·H2O浓度增大,促使NH3·H2O分解(或其它合理解释) 挤压胶头滴管,打开止水夹 红
NH4++OH-逆向移动,使NH3·H2O浓度增大,促使NH3·H2O分解(或其它合理解释) 挤压胶头滴管,打开止水夹 红
【解析】
实验室制取NH3,即可用铵盐和碱共热的方法,也可在常温下将浓氨水滴到入氢氧化钠或碱石灰等固体上的方法;本题喷泉实验利用的是氨气极易溶于水的性质,引发喷泉的操作可基于此考虑。
(l)①方法i制取氨气的原理是:铵盐能和碱共热生成氨气,化学方程式为:2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O。答案为:2NH4Cl + Ca(OH)2
CaCl2 + 2NH3↑+2H2O。答案为:2NH4Cl + Ca(OH)2![]() CaCl2 + 2NH3↑+2H2O
CaCl2 + 2NH3↑+2H2O
②方法ii是在常温下用固体氢氧化钠与浓氨水混合,产生氨气的原因是:氢氧化钠固体溶于水时,放出大量的热,使浓氨水中的NH3·H2O分解产生氨气,同时增大了OH-浓度,使平衡NH3·H2O![]() NH4++OH-逆向移动,使NH3·H2O浓度增大,促使NH3·H2O分解;该反应不需要加热,所以应选用的发生装置是B。答案为:B;氢氧化钠固体溶于水时,放出大量的热,使浓氨水中的NH3·H2O分解产生氨气,同时增大了OH-浓度,使平衡NH3·H2O
NH4++OH-逆向移动,使NH3·H2O浓度增大,促使NH3·H2O分解;该反应不需要加热,所以应选用的发生装置是B。答案为:B;氢氧化钠固体溶于水时,放出大量的热,使浓氨水中的NH3·H2O分解产生氨气,同时增大了OH-浓度,使平衡NH3·H2O![]() NH4++OH-逆向移动,使NH3·H2O浓度增大,促使NH3·H2O分解(或其它合理解释)
NH4++OH-逆向移动,使NH3·H2O浓度增大,促使NH3·H2O分解(或其它合理解释)
(2)本题中,喷泉形成的原因,是由于瓶内压强降低,与外界大气产生很大的压强差所致,所以,要引发喷泉,应设法使烧瓶内的气体大量减少。本题中的装置引发的方法是,挤压胶头滴管,使水进入烧瓶,由于氨气极易溶于水,氨气大量溶解,压强急剧降低,打开止水夹,外界大气压将烧杯内的水压入烧瓶,形成喷泉;氨气溶于水,部分氨气与水反应生成NH3·H2O,使得氨水显碱性,所以如果水中滴有无色酚酞试液,则形成喷泉后,烧瓶里的溶液呈红色。答案为:挤压胶头滴管,打开止水夹;红


科目:高中化学 来源: 题型:
【题目】T℃时,在1L的密闭容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
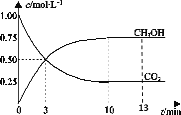
A.T℃时,平衡常数K=3,CO2与H2的平衡转化率相等
B.T℃时,上述条件下达到平衡时放出49.0kJ的热量
C.降温和缩小容器体积均可使反应的平衡常数增大
D.从反应开始到3min,H2的平均反应速率υ(H2)=0.5molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷和Cl2(g)反应的能量关系如图所示。下列叙述正确的是
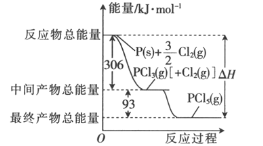
A.PCl5(g)比PCl3(g)稳定B.加入催化剂不会改变△H的大小
C.整个过程吸收的能量为399kJD.PCl3(g)的燃烧热△H=-93kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷基烯酮二聚体(AKD)是造纸工业上常用的一种浆内施胶剂,其结构简式如图所示,下列说法正确的是( )
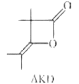
A.AKD的分子式为C8H14O2
B.AKD与NaOH溶液能发生皂化反应
C.AKD分子中所有碳原子处于同一平面
D.AKD能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1的盐酸分别滴定20.00mL 0.1000mol·L-1氨水和20.00mL 0.1000mol·L-1 NaOH溶液,滴定曲线如图所示。下列说法不正确的是
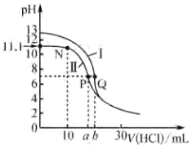
A.25℃,Kb(NH3·H2O)的数量级为10-5
B.N点处的溶液中:c(NH![]() )>c(NH3·H2O)
)>c(NH3·H2O)
C.曲线II滴定终点时所选的指示剂为酚酞
D.Q点所加盐酸的体积为b mL,则b=20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在T1温度下,向容积为1L的恒容密闭容器中,同时通入0.1mol CO(g)和0.1mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g)△H=a kJ·mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。

(1)0~10min内,CO的平均反应速率为_____________
(2)T1温度下,该反应的平衡常数K为_______________(用分数表示)。
(3)已知:I.H2的燃烧热 △H=-285.8 kJ·mol-1;
II.CO的燃烧热 △H=-283 kJ·mol-1;
III.H2O(g)![]() H2O(l) △H=-44 kJ·mol-1。则a=______________
H2O(l) △H=-44 kJ·mol-1。则a=______________
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1、c(H2)=0.4 mol·L-1、c(CO2)=0.4 mol·L-1,则该反应在下一时刻将_______ (填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计实验制备NaHSO2·HCHO·2H2O[次硫酸氢钠甲醛(雕白块)]。回答下列问题:
⑴甲同学用下列装置制备实验原料Na2S2O5(焦亚硫酸钠),装置如图:

已知pH=4.1的过饱和NaHSO3溶液能自动脱水生成Na2S2O5。
①通入H2的目的是___。
②通入SO2发生反应的化学方程式依次为___、___和2NaHSO3=Na2S2O5↓十H2O。
③从环境保护和安全考虑,尾气处理方法正确的是___ (填字母)。
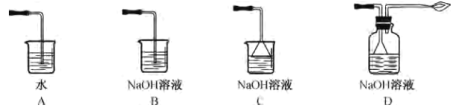
④实验若用稀NaOH溶液,则不能制得Na2S2O5,其原因是___。
⑵乙同学用甲同学制得的Na2S2O5通过下列装置(夹持装置已略)合成雕白块。
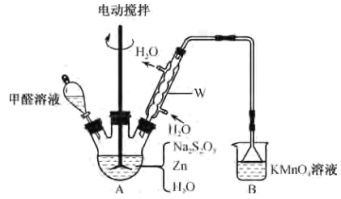
①仪器W的名称是___。
②合成反应温度需保持在75℃,采用的合适加热方式是___,已知反应中Zn转化为ZnO和Zn(OH)2,三口烧瓶中发生反应的化学方程式为___。
③三口烧瓶中的反应液需经过过滤、___、过滤、洗涤及干燥,得雕白块。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )
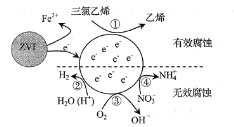
A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
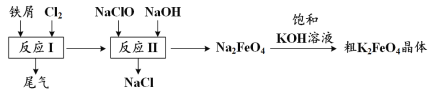
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com