

分析 粗盐水加入沉淀剂沉淀Ca2+、Mg2+和SO42-离子,过滤得到 滤液调节溶液PH至酸性,加热浓缩得到饱和氯化钠溶液,电解得到氢氧化钠、氯气和氢气,通入氨气、二氧化碳得到碳酸氢钠晶体,加热分解得到碳酸钠,
(1)根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀;
(2)加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析;
(3)电解饱和食盐水生成氢氧化纳、氢气和氯气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;从饱和食盐水中获得食盐晶体,依据氯化钠溶解度随温度变化不大分析得到晶体的方法;
(4)CH3COOH与NaOH的物质的量相同,恰好反应生成CH3COONa,CH3COO-水解显碱性,结合溶液中电荷守恒分析离子浓度大小;
(5)根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
A.NaHCO3属于盐类,纯碱是碳酸钠属于盐;
B.溶液中通入足量的CO2会和碳酸钠溶液发生反应生成碳酸氢钠;
C.常温下在水中的溶解度,NaHCO3小于纯碱;
D.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,碳酸氢钠直接生成二氧化碳,碳酸钠先生成碳酸氢钠,最后生成二氧化碳,产生气泡的速率不相同.
解答 解:(1)总体思路是先沉淀再过滤,沉淀时要先加BaCl2溶液,再加Na2CO3溶液,因为碳酸钠能把过量的氯化钡沉淀出来,氢氧化钠可放在它们前面,也可放在它们后面或中间,都完全沉淀完后再过滤;
故答案为:cab或者cba或者bca;
(2)加入适量盐酸pH调至酸性除去的离子是CO32-和OH-,故答案为:CO32-和OH-;
(3)电解饱和食盐水制取氯气的反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;从饱和食盐水中获得食盐晶体的方法是利用氯化钠溶解度随温度变化不大分析,用蒸发结晶方法得到,采用蒸发结晶的方法,使用的仪器是蒸发皿、酒精灯、玻璃棒等,选C,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;C;
(4)CH3COOH与NaOH的物质的量相同,恰好反应生成CH3COONa,CH3COO-水解显碱性,其水解方程式为:CH3COO-+H2O?CH3COOH+OH-,溶液中c(H+)<c(OH-),结合溶液中电荷守恒计算得到,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(Na+)>c(CH3COO-),
故答案为:碱,>;
(5)向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,
A.NaHCO3属于盐类,纯碱是碳酸钠是金属阳离子和酸根阴离子构成属于盐,故A错误;
B.除去NaHCO3溶液中的纯碱,应往溶液中通入足量的CO2发生反应Na2CO3+CO2+H2O=2NaHCO3,可以除去,故B正确;
C.常温下在水中的溶解度,NaHCO3小于纯碱,故C错误;
D.分别往同浓度的NaHCO3溶液和纯碱溶液中滴加稀盐酸,碳酸氢钠直接生成二氧化碳,碳酸钠先生成碳酸氢钠,最后生成二氧化碳,产生气泡的速率不相同,故D错误;
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,B;
点评 本题主要考查了粗盐的提纯、候氏制碱的原理、利用方程式计算,难度中等,根据课本知识即可完成,注意碳酸钠和碳酸氢钠的性质不同.


科目:高中化学 来源: 题型:多选题
| A. | NaX的水溶液的碱性一定强于NaY水溶液的碱性 | |
| B. | HX一定是弱酸 | |
| C. | 反应结束时两者所用时间相同 | |
| D. | 浓度:C(HX)>C(HY) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在加热条件下能使不活泼金属铜溶解,表现出浓硫酸的强氧化性和酸性 | |
| B. | 可以用铁制或铝制容器贮运,表现出浓硫酸有稳定的化学性质 | |
| C. | 能使胆矾晶体由蓝色变为白色,表现出浓硫酸的脱水性 | |
| D. | 能使蔗糖炭化,表现出浓硫酸的吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
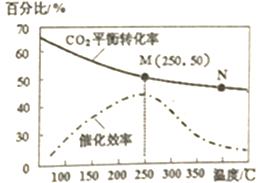 一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 平衡常数:KM<KN | |
| C. | 催化剂对CO2的平衡转化率没有影响 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
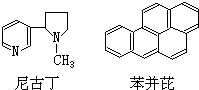 吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:
吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:| A. | 尼古丁的分子式为C10H14N2 | |
| B. | 尼古丁分子中的所有原子都在同一平面上 | |
| C. | 苯并芘的分子式为C20H18 | |
| D. | 苯并芘分子中含有苯环结构单元,是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com