
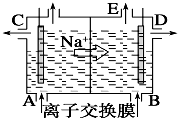
| A、从E口逸出的气体是H2 |
| B、从B中加入含少量NaOH的水溶液以增强导电性 |
| C、标准状况下每生成22.4LCl2,便产生2molNaOH |
| D、完全电解后加适量盐酸可以恢复到电解前的浓度 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、以O2浓度变化表示的反应速率为0.064 mol?(L?s)-1 | ||
| B、反应达到平衡状态时NH3的转化率为20% | ||
C、升高温度能使
| ||
| D、将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
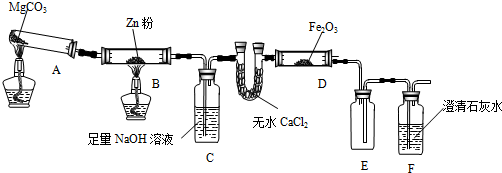
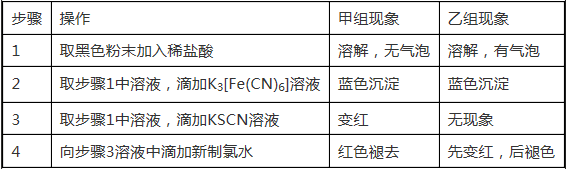
查看答案和解析>>
科目:高中化学 来源: 题型:
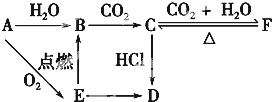
查看答案和解析>>
科目:高中化学 来源: 题型:
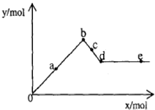 已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系.
已知Ba(AlO2)2可溶于水.如图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系.| A、a-b时沉淀的物质的量:A1(OH)3比BaSO4多 |
| B、c-d时溶液中离子的物质的量:AlO2-比Ba2+多 |
| C、a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3 |
| D、d-e时溶液中离子的物质的量:整个阶段Ba2+一定不会等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
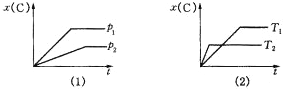
| A、T1>T2,△H>0 |
| B、T1>T2,△H<0 |
| C、T1<T2,△H>0 |
| D、T1<T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l);△H=-Q1,2H2(g)+O2(g)=2H2O (g);△H=-Q2 | ||||
| B、S(g)+O2(g)=SO2(g);△H=-Q1,S(s)+O2(g)=SO2(g);△H=-Q2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)=2HCl(g);△H=-Q1,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com