
【题目】已知非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,B原子的最外层电子数是内层电子数的2倍,通常状况下E的单质是黄色晶体,不溶于水,易溶于二硫化碳,D与E在同一主族,C、D在周期表中处于相邻的位置,请回答下列问题:
(1)A元素的名称是________,E的阴离子结构示意图是__________________。
(2)元素C的最高价氧化物对应水化物与其气态氢化物反应生成化合物Z,该反应的离子方程式为____________________________________________,化合物Z属于________________(填“离子化合物”或“共价化合物”),Z中含有的化学键类型是________________。
(3)C元素的最高价氧化物对应的水化物的稀溶液能与D、E元素形成的一种化合物发生氧化还原反应,其离子反应方程式为__________________________。
【答案】氢  NH3+H+=NH4+ 离子化合物 离子键、共价键 3SO2+2H2O+2NO3- = 3SO42-+2NO+4H+
NH3+H+=NH4+ 离子化合物 离子键、共价键 3SO2+2H2O+2NO3- = 3SO42-+2NO+4H+
【解析】
非金属元素A、B、C、D、E均属于短周期元素,其原子序数依次增大,A元素原子形成的离子核外电子数为零,则A为H;B原子的最外层电子数是内层电子数的2倍,有2个电子层时,则B为C;通常状况下E的单质是黄色晶体,易溶于二硫化碳,则E为S;D与E在同一主族,A、B、C、D、E的原子序数依次增大,则D为O;C、D在周期表中处于相邻的位置,则C为N,据此解答。
分析知:A为H、B为C、C为N、D为O、E为S;
(1)A元素的名称是氢,E为S元素,S2-结构示意图是 ;
;
(2)元素C为N ,其最高价氧化物对应水化物为HNO3,其气态氢化物为NH3,两者反应生成NH4NO3,发生反应的离子方程式为NH3+H+=NH4+,NH4NO3属于离子化合物,含有的化学键类型是离子键、共价键;
(3) 元素C为N ,其最高价氧化物对应水化物为HNO3,D、E元素形成的一种化合物有SO2和SO3,其中SO2能被稀硝酸氧化生成硫酸,同时生成的还原产物为NO,则发生反应的离子反应方程式3SO2+2H2O+2NO3- = 3SO42-+2NO+4H+。


科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某硏究小组为硏究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。

回答下列问题:
(1)写出Fe2+水解的离子方程式___;要抑制FeSO4水解,可以采取的措施是___。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率___。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+![]() 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响___。
(5)研究小组在查阅资料时还得知:氧气的氧化性随溶液的酸性增强而增强。通过以上研究可知,配制FeSO4溶液的正确做法是___。
(6)用K2Cr2O7标准溶液測定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L-1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质
B.苯和浓硝酸在55~60℃,浓硫酸存在时发生硝化反应
C.甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应
D.等质量的烃(CxHy)耗氧量取决于![]() 的值,越大则耗氧多
的值,越大则耗氧多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
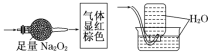
A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
Ⅰ.(1)将等质量的钾、钠、镁、铝分别投入到足量的同浓度的盐酸中,试预测实验结果:上述金属中_____与盐酸反应最剧烈,_____与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_____________________________________。
Ⅱ.利用图装置来验证同主族元素非金属性的变化规律:

(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____________的现象,即可证明。干燥管D的作用是_________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_____溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量_____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。改进后C中发生反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:

资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为日常生活中最常见的液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质之间的转化关系如图所示。下列说法正确的是
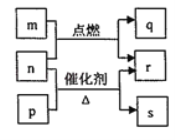
A.m与r中所含化学键类型相同
B.r的沸点高于p的沸点
C.m与q混合没有明显现象
D.q与s均为酸性氧化物,m的水溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题。
(1)焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了________而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,图是松脂酸铜的结构简式。请分析

1个松脂酸铜中π键的个数为________;加“*”碳原子的杂化方式为________。
(3)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型为________,比较第一电离能:S________O(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )

A. 每个原子都达到8电子稳定结构
B. 分子中5个R—Cl键键能不相同
C. 键角(Cl—R—Cl)有90°、120°、180°几种
D. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com