
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。现从废料(含Co3O4、Al、Si、Li2O、Fe2O3等物质)中提纯电子级钴的氧化物,其工业制取流程如下:
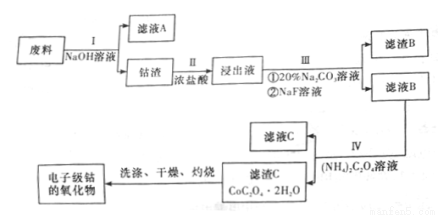
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)废料在处理前要粉碎,其主要目的是(回答两个方面)___________;
步骤I得到的滤液A中的溶质为___________(填化学式)。
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为_________。
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为___________;滤渣B的主要成分为____________。
(4)步骤I、III、IV中均用到的分离提纯方法为_______,在实验室中完成该操作用到的玻璃仪器是__。
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.25 |
400~500 | 2.41 |
290℃~320℃时若生成两种气体,则发生反应的化学方程式为___________,400℃~500℃所得固体的化学式为__________。
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
化学与生产生活密切相关,下列物质的用途及解释均正确的是
选项 | 用途 | 解释 |
A | 可用FeCl3溶液刻蚀铜制电路板 | Fe3+的氧化性强于Cu2+ |
B | 碳与石英反应可冶炼粗硅 | 碳的非金属性比硅强 |
C | 四氯化碳可用于灭火 | 四氯化碳的沸点高 |
D | 酸性KMnO4溶 液可漂白织物 | KMnO4有强氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:计算题
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
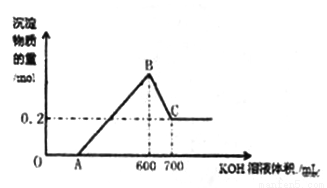
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作或装置正确的是( )
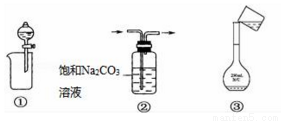
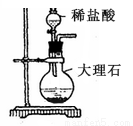
A. ①分离出BaSO4浊液中的BaSO4 B. ②除去CO2中少量HCl气体
C. ③配制一定物质的量浓度溶液时转移溶液 D. ④制取一定量的CO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
判断下列有关化学基本概念或名词的依据正确的是( )
A. 共价化合物:是否含有共价键
B. 纯净物与混合物:是否仅含有一种元素
C. 电解质与非电解质:物质本身是否具有导电性
D. 溶液与胶体:本质在于分散质粒子直径的大小
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三2月份模拟演练理综化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中,可能大量共存的是
A. 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br-
B. 水电离出的c(H+)=10-13mol·L-1的溶液中:Fe3+、K+、CO32-、SO32-
C. 室温下,  =0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
=0.1mol·L-1的溶液中:Al3+、Na+、SiO32-、HCO3-
D. 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三第一次模拟考试化学试卷(解析版) 题型:填空题
硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,图示如下:

(1)下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | 472 | 496 |
则反应I的△H=_______kJ/mol。反应Ⅲ的化学方程式为__________________。
(2)从废钒催化剂中回收V2O5的过程如下:

①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式_________。
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为________[25℃,Ksp(NH4VO3) =1.6×10-3,溶液体积变化忽略不计]。
(3)采用脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。
①向此溶液稀溶液中再加入少量(NH4)2SO4固体,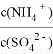 将_______(填“变大”、“不变”或“变小”)。
将_______(填“变大”、“不变”或“变小”)。
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
=_______(用含a的代数式表示,NH3·H2O的Kb=1.7×10-5)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A. 锌与CH3COOH溶液反应:Zn+2H+===Zn2++H2↑
B. 氢氧化铝与稀硝酸反应:H++OH-===H2O
C. CuCl2溶液与铁粉反应:3Cu2++2Fe===3Cu+2Fe3+
D. MgCl2溶液与氨水反应:Mg2++2NH3·H2O===Mg(OH)2↓+2NH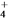
查看答案和解析>>
科目:高中化学 来源:2017届安徽省淮南市高三第一次模拟考试理综化学试卷(解析版) 题型:推断题
某吸水材料与聚酯纤维都是重要的化工原料。它们的合成路线如图所示:

已知:①A由C、H、O三种元素组成,相对分子质量为32。
②RCOOR′+R″OH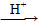 RCOOR″+R′OH(R、R′、R″代表烃基)。
RCOOR″+R′OH(R、R′、R″代表烃基)。
请回答下列问题:
(1) A的结构简式是____________________。
(2) B中的官能团名称是______________________。
(3) D→E的反应类型是______________。
(4) ①乙酸与化合物M反应的化学方程式是_________________________________
②G→聚酯纤维的化学方程式是______________。
(5) E的名称是___________。
(6) G的同分异构体有多种,满足下列条件的共有_____种。
①苯环上只有两个取代基;
② 1 mol该物质与足量的NaHCO3溶液反应生成2 mol CO2。
(7) 写出由 合成
合成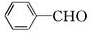 的流程图(注明反应条件)________。
的流程图(注明反应条件)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com