
氧是地壳中含量最多的元素
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内O﹣H键、分子间的范德华力和氢键从强到弱依次为 . 沸点比
沸点比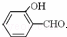 高,原因是 形. .
高,原因是 形. .
(3)H+可与H2O形成H3O+,H3O+中O原子采用 杂化.H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因是 .
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO的密度为ag•cm﹣3,NA表示阿伏家的罗常数,则CaO晶胞的体积为 .
cm3.
考点:
化学键和分子间作用力的区别;原子核外电子的能级分布;晶胞的计算;分子间作用力对物质的状态等方面的影响.
专题:
压轴题.
分析:
(1)s能级有一个轨道,最多排2个电子,p能级有3个轨道,每个轨道最多排2个电子,结合洪特规则分析;
(2)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(3)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
(4)先计算一个氧化钙分子的质量,再用均摊法求出一个晶胞含有的阴阳离子数,然后根据V=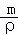 求出其体积.
求出其体积.
解答:
解:(1)氧元素基态原子核外电子排布式为1s22s22p4,4个电子在三个轨道中排布,故未成对电子数为2个,故答案为:2;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O﹣H键、分子间的范德华力和氢键从强到弱依次为O﹣H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O﹣H键、氢键、范德华力;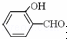 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小
(4)1个“CaO”的质量为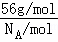 =
=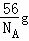 ,而用均摊法算出一个晶胞含有4个“CaO”,即一个晶胞质量为
,而用均摊法算出一个晶胞含有4个“CaO”,即一个晶胞质量为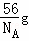 ×4=
×4=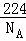 g,又有ρ=
g,又有ρ=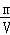 ,则V=
,则V=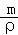 ,
,
V=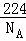 g÷ag/cm3=
g÷ag/cm3=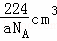 ,则CaO晶胞体积为
,则CaO晶胞体积为 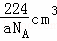 .
.
故答案为: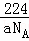 .
.
点评:
本题把物质结构和性质与有机化合物的性质融合成一体,考查学生对元素推理、原子轨道杂化类型、分子空间结构、氢键、等电子体原理、晶胞结构等知识的掌握和应用能力.本题基础性较强,难度较大,注意晶胞体积的计算方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列事实中,不能用勒沙特列原理解释的是( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的稀盐酸;
③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;
④向硅酸钠溶液中逐滴加入过量的盐酸.
A. ①② B. ①③ C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
|
| A. | 三者对应的氧化物均为碱性氧化物 |
|
| B. | 三者的单质放置在空气中均只生成氧化物 |
|
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
|
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是( )
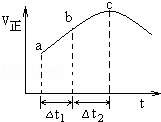
|
| A. | 反应在c点达到平衡状态 |
|
| B. | 反应物浓度:a点小于b点 |
|
| C. | 反应物的总能量低于生成物的总能量 |
|
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质④不锈钢和目前流通的硬币都是合金⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑥豆浆和雾都是胶体。上述说法正确的是( )
A.①③④⑥ B.①⑤⑥ C.①②④⑤ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C, 盐碱地(含较多NaCl、Na2CO3)中加入石膏, 降低土壤的碱性,涉及的方程式为
Ca2++CO32-=CaCO3↓
D. 在海带灰的滤液中加入几滴稀硫酸,再加入双氧水,即能使淀粉溶液变蓝
2I-+H2O2+2H+= I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3 + CO2 + NaCl + H2O == NH4Cl + NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
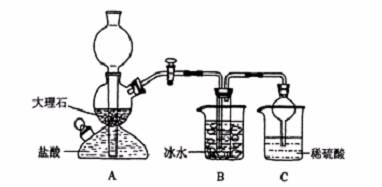
(1)A装置中所发生反应的离子方程式为: 。
C装置中稀硫酸的作用为: 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水是因为 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com