
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另—份中逐渐加入铁粉,产生气体的量随铁粉质量的增加的变化关系如图所示(已知硝酸只被还原为 NO气体)。下列分析或结果错误的是
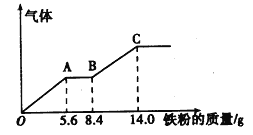
A. 原混合酸中NO3-的物质的量为0.1mol
B. 第二份溶液中最终溶质为FeSO4
C. OA段产生的是NO,AB段的反应为Fe+2Fe3+==3Fe2+,BC段产生氢气
D. H2SO4浓度为2.5 molL-1
【答案】A
【解析】一份中加入Cu,发生的离子反应是3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,根据图像,NO3-在酸性条件具有强氧化性,因此先发生Fe+4H++NO3-=Fe3++NO↑+2H2O,AB段没有气体产生,此段反应是Fe+2Fe3+=3Fe2+,BC段有气体产生,说明H+过量,发生Fe+2H+=Fe2++H2↑,A、根据上述分析,OA段NO3-全部反应,此段消耗铁的质量为5.6g,即消耗NO3-物质的量为0.1mol,原溶液平均分为两份,因此原溶液中NO3-的物质的量为0.2mol,故A说法错误;B、根据图像的分析,最终溶质为FeSO4,故B说法正确;C、根据上述分析,故C说法正确;D、最终溶质为FeSO4,此时消耗铁的质量为14g,则n(SO42-)=14/56mol=0.25mol,因此原溶液中硫酸的物质的量为0.25×2mol=0.5mol,即硫酸浓度为0.5/200×10-3mol·L-1=2.5mol·L-1,故D说法正确。


科目:高中化学 来源: 题型:
【题目】根据要求,用化学用语表示下列有关反应:
(1)用KOH溶液作电解质溶液,石墨作电极,C3H8燃料电池中负极的电极反式:__________;
(2)向Na2S2O3溶液中稀硫酸的化学方程式:_________;
(3)用CO气体还原1molFe2O3固体,放出热量24.8kJ,该反应的热化学方程式:______________;
(4)向酸性高锰酸钾溶液中加入H2C2O4溶液的离子方程式:_________________;
(5)用石墨作电极电解氯化钠水溶液,写出电解的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2+xOH-=Fe(FeO2)2+S4O62-+2H2O,下列说法中不正确的是
A.每生成1molFe(FeO2)2转移4mol电子
B.该反应中Fe2+和S2O32-都是还原剂
C.3molFe2+被氧化时有1molO2被还原
D.反应方程式中化学计量数x=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤MgCl2 ⑥Ar ⑦CO2 ⑧CaF2 ⑨NH4Cl ⑩CaO2 ![]() Ca(ClO)2
Ca(ClO)2 ![]() N2H4等物质填空。
N2H4等物质填空。
(1)只存在离子键的是________;
(2)由离子键和极性键构成的是_________;
(3)由离子键和非极性键构成的是_________;
(4)由极性键和非极性键构成的是_________;
(5)写出下列物质的电子式:Na2S2:_________;(NH4)2S:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质。

下列说法正确的是
A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B. Ⅱ图中:量筒中发生了加成反应
C. Ⅲ图中:生成蓝色的烟
D. Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )
A.食盐与蔗糖的熔化B.汞和溴的挥发
C.碘和干冰的升华D.二氧化硅和氧化钠的熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 甲烷是最简单的烷烃,其含碳量最高
B. 烷烃完全燃烧,生成CO2和H2O的物质的量相等
C. 烯烃的分子组成中,碳和氢的质量比固定不变,烯烃通式为CnH2n(n≥2)
D. 分子式:C3H6和C4H8一定互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com