

 Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)
Fe3O4+6SO2;(没配平扣1分,无高温不扣分。)  Fe3O4+6SO2 ;
Fe3O4+6SO2 ;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:实验题
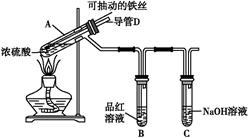
| 实验操作步骤 | 实验现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②④ | C.②③ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
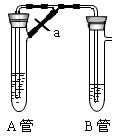
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
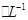 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为| A.5.6g | B.11.2 g | C.22.4g | D.33.6g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
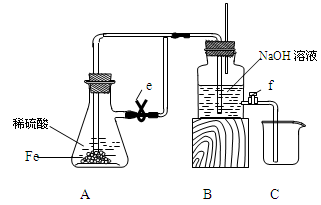
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
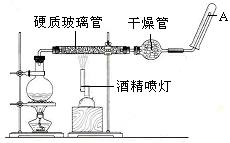
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
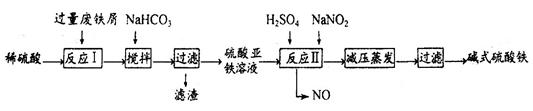
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com