
| A. | Na→NaOH→Na2CO3→NaCl | B. | Cu→CuO→Cu (OH)2→CuCl2 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
分析 A.钠和水反应生成氢氧化钠,氢氧化钠和二氧化碳反应生成碳酸钠,碳酸钠和氯化钙反应生成碳酸钙进而氯化钠;
B.铜和氧气反应生成氧化铜,氧化铜不能一步反应生成氢氧化铜;
C.镁和氯气反应生成氯化镁,氯化镁和氢氧化钠溶液反应生成氢氧化镁沉淀,氢氧化镁沉淀溶解于硫酸生成硫酸镁;
D.铁和盐酸反应生成氯化亚铁,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,空气中氢氧化亚铁被氧气氧化生成氢氧化铁.
解答 解:A.钠和水反应生成氢氧化钠,2Na+2H2O=2NaOH+H2↑,氢氧化钠和二氧化碳反应生成碳酸钠,2NaOH+CO2=Na2CO3+H2O,碳酸钠和氯化钙反应生成碳酸钙进而氯化钠,Na2CO3+CaCl2=CaCO3↓+2NaCl,能一步实现反应,故A不符合;
B.铜和氧气反应生成氧化铜,氧化铜不能一步反应生成氢氧化铜,故B符合;
C.镁和氯气反应生成氯化镁,Mg+Cl2=MgCl2,氯化镁和氢氧化钠溶液反应生成氢氧化镁沉淀,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,氢氧化镁沉淀溶解于硫酸生成硫酸镁,Mg(OH)2+H2SO4=MgSO4+2H2O;
D.铁和盐酸反应生成氯化亚铁,Fe+2HCl=FeCl2+H2↑,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,FeCl2+2NaOH=Fe(OH)2+↓2NaCl,空气中氢氧化亚铁被氧气氧化生成氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3,故D不符合;
故选B.
点评 本题考查金属及化合物转化及性质,为高频考点,明确物质的性质是解本题关键,注意把握Na、Mg、Cu、Fe为知识点构建知识网络,归纳元素化合物知识,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液、过滤、蒸馏 | B. | 过滤、蒸馏、分液 | C. | 分液、蒸馏、过滤 | D. | 蒸馏、过滤、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+) | |
| B. | 1 L0.l mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(X-)>c(H+)>(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 碱性氧化物 | 非电解质 | 弱酸 | 胶体 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某饮料公司的广告语为“本公司生产的饮料不含任何化学物质” | |
| B. | 该科研人员发明了一种特殊催化剂,可以使水变为汽油 | |
| C. | 有关部门利用明矾对饮用水进行消毒杀菌,从而解决了灾民饮水难的问题 | |
| D. | 该科研机构发明了一种用植物秸秆生产乙醇的新工艺 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质 | B. | 元素 | C. | 分子 | D. | 氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
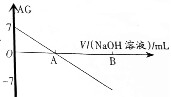 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-6 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(H+)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com