
【题目】下列离子能在强碱性溶液中大量共存,且溶液为无色透明的是( )
A.K+、MnO4-、Mg2+、Cl-B.Na+、Ba2+、HCO3-、NO3-
C.Na+、NO3-、CO32-、Cl-D.K+、H+、Cl-、SO42-
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】CaCO3的摩尔质量为100gmol —1。将5.0gCaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100ml溶液。该溶液中Ca2+的物质的量浓度为
A.5.0 molL—1 B.0.10 molL—1 C.1.0 molL—1 D.0.50 molL—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2﹣)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( ) 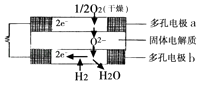
A.该电池的总反应方程式为:2H2+O2=2H2O
B.电子由a极流向b极
C.a极对应的电极反应式为2H2O+O2﹣4e=4OH﹣
D.有O2参加反应的a极为电池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙是三种常见的单质,A、B、C是三种常见的二元无机化合物,它们之间的转化关系如右图所示。请回答下列有关问题:
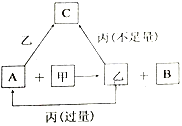
(1)若甲为常见气态非金属单质,丙为金属单质,三种单质中只有甲由短周期元素组成;甲与乙同主族、乙与丙同周期;它们的转化关系均在溶液中进行。则:
①甲物质的名称为___________。
②丙元素在元素周期表中的位置是___________。
③反应A+甲→乙+B的离子方程式为______________________。
④请简述B中阳离子的检验方法__________________________________。
(2)若甲为常见金属单质,乙为常见固态非金属单质,且所有物质组成元素均为短周期元素。则:
①乙的化学式为___________。
②A的电子式为___________。
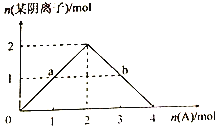
③将A缓慢通入氢氧化钠溶液中,所得溶液中的某种阴离子的物质的量随n(A)的通入转化关系如右图所示。图中a、b两点的溶液中水的电离程度的大小关系为a_______b(填“>”、“=”或“<")。若溶液X为图中曲线上任意一点,则向溶液X中逐滴加入盐酸至反应完全,消耗盐酸的物质的量最大为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、蒸馏、萃取B.萃取、蒸馏、分液
C.分液、萃取、蒸馏D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
I.(1)N2O是一种典型的温空气体,在一定条件下,其分解的化学方程式为:2N2O(g)==2N2(g) +O2(g) △H________________。
(2)已知一定条件下有下列反应:
①2N2O5(g)![]() 4NO2(g)+ O2(g) △H1
4NO2(g)+ O2(g) △H1
②2NO2(g)![]() 2NO(g)+ O2(g) △H2
2NO(g)+ O2(g) △H2
③2NaOH(aq)+ N2O5(g)![]() 2NaNO3(aq)+H2O(1) △H3
2NaNO3(aq)+H2O(1) △H3
写出NO与O2的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式_____________________________。在容积为2L 的恒容密闭容器中充入1.00mol N2O5,假设在T℃时只发生反应①、②,若达到平衡状态后O2 为1.00mol,NO2为0.400mol,则T℃时反应①的平衡常数的值为_______________________。
II.联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(3)联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式_______________。
(4)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3:2,则该分解反应的化学方程式为_____________________________________。
(5)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g) +4NO(g) +O2(g) ![]() 4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。
4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。

A.在催化剂甲作用下,图中Y点处(210℃) NO的转化率一定不是该温度下的平衡转化率
B.在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是催化剂活性降低
C.300℃时,NO的平衡转化率M点高于Z点的原因是乙催化剂催化效率高
D.其他条件不变,增加NH3的浓度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
III.NH3是一种重要的化工原料。
(6)NH3和Cr2O3 固体高温下可以制备多功能材料CrN晶体,其反应为Cr2O3 (s) +2NH3(g) ![]() 2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
已知A是芳香烃,苯环上只有一个取代基,A完全加氢后分子中有两个甲基,E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色,其可以用来合成新型药物H,合成路线如图所示。

已知:

请回答下列问题:
(1)写出有机物A的结构简式:____________。有机物D中存在的官能团名称为_______________。
(2)上述反应过程中属于取代反应的有________________(填序号)。
(3)有机物H在一定条件下可以聚合形成高分子,写出该聚合物的结构简式:_______________________。
(4)写出H在氢氧化钠催化作用下的水解方程式:_________________________。
(5)有机物E有多种同分异构体,写出符合下列条件的同分异构体的结构简式:_________________。
a.存在苯环且苯环上核磁共振氢谱只有2组峰值
b.与新制Cu(OH)2悬浊液作用产生砖红色沉淀
c.加入FeCl3溶液显色
(6)参照H的上述合成路线,设计一条由石油产品和NH2—CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线:___________________________________________________________________(需注明反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com