
| A. | 氮分子  | B. | 过氧化氢  | C. | Na2O  | D. | 氯气 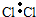 |
分析 A.氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键;
B.双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
C.氧化钠为离子化合物,2个钠离子与氧离子通过静电作用结合而成;
D.氯气分子中存在一对共用电子对,氯原子最外层达到8电子稳定结构,漏掉了氯原子中的未成键电子;
解答 解:A.氮分子的电子式为 ,故A错误;
,故A错误;
B.双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故B错误;
,故B错误;
C.氧化钠为离子化合物,2个钠离子与氧离子通过静电作用结合而成,电子式为: ,故C正确;
,故C正确;
D.氯气分子中,两个氯原子的最外层都达到8电子稳定结构,氯气正确的电子式为: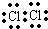 ,故D错误;
,故D错误;
故选:C.
点评 本题考查了常见化学用语的书写判断,掌握常见化学用语的概念及书写原则,明确常见原子、分子、阴阳离子等粒子的电子式的表示方法及区别是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该化合物与Br2能发生加成反应和取代反应 | |
| B. | 1 mol该化合物与NaOH溶液反应时最多消耗3 mol NaOH | |
| C. | 该化合物能使酸性高锰酸钾溶液褪色 | |
| D. | 该化合物能和Na2CO3溶液反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
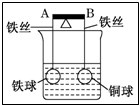
| A. | 杠杆为导体或绝缘体时,均为B端高A端低 | |
| B. | 杠杆为导体或绝缘体时,均为B端低A端高 | |
| C. | 当杠杆为导体时,B端低A端高;杠杆为绝缘体时,B端高A端低 | |
| D. | 当杠杆为导体时,B端高A端低;杠杆为绝缘体时,B端低A端高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,21.0 g乙烯与丙烯的混合气体中含有的碳原子数为1.5 NA | |
| B. | 常温常压下,0.1molC8H18所含有的共价键数目为2.0 NA | |
| C. | 0.1mol乙醇与氧气完全反应生成二氧化碳时转移电子数为0.1NA | |
| D. | 标准状况下,2.24L乙酸乙酯中所含氧原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水检验CH2═CH-CHO中是否含有碳碳双键 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
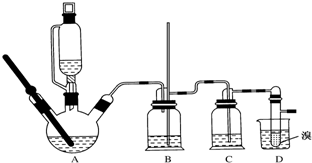
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状 态 | 无 色 液 体 | 无 色 液 体 | 无 色 液 体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com