
����Ŀ��NԪ���γɵĻ�����ḻ��ʣ��Իش��������⣺
(1)������ͭ��Һ����μ��백ˮ�Ȳ���������������ܽ�Ϊ����ɫ��Һ,�����Ҵ���������ɫ���塣
�ٻ�̬ͭԭ�ӵĺ�������Ų�ʽΪ________________��
��1mol����ɫ������������к��еĦҼ�����ĿΪ___________��
�ۼ�Ҫ����Ϊʲô�����Ҵ����о�������_____________________________��
(2)��֪���ǻ������ĽṹʽΪ![]() ���Ƚϣ����ǻ������ķе�_____________���ǻ������ķе�(����ڡ��� �����ڡ��� ����ȷ����);���̷��¼��е������������谷���ṹ��ʽΪ
���Ƚϣ����ǻ������ķе�_____________���ǻ������ķе�(����ڡ��� �����ڡ��� ����ȷ����);���̷��¼��е������������谷���ṹ��ʽΪ![]() ���÷����е�ԭ�ӵ��ӻ���ʽΪ________________;����Ͷ������������Nһ����������,�ṹ��ʽΪ
���÷����е�ԭ�ӵ��ӻ���ʽΪ________________;����Ͷ������������Nһ����������,�ṹ��ʽΪ![]() ,��÷������漰�ĵڶ�����Ԫ�ص�һ��������С�����˳��Ϊ____________________��
,��÷������漰�ĵڶ�����Ԫ�ص�һ��������С�����˳��Ϊ____________________��
(3)��֪CuN3�е���������CO2��Ϊ�ȵ����壬CuN3����ľ������Ȼ��Ƶľ������ơ�
����д��CuN3�е������ӵĵ���ʽ__________________��
����֪�þ��徧���߳�a,b,c,��ϵΪa=b___________����
(4)��֪NH3,NF3,N(CH3)3��������ͭ�������������ӡ�
���ȶ���[Cu(NH3)4]2+__________[Cu(NF3)4]2+��(����ڡ�, �����ڡ�,����ȷ���� )
����֪�ȶ���[Cu(NH3)4]2+����[Cu[N(CH3)3]4]2+,���Ҫ����ԭ��_______________________��
���𰸡� 1s22s22p63s23p63d104s1 16NA �����Ҵ��������ܼ��ļ���,������ܽ�Ƚ��� ���� sp2,sp3 C<O<N ![]() 4 ���� N(CH3)3�����,�ռ�ӵ��
4 ���� N(CH3)3�����,�ռ�ӵ��
��������(1) ��ͭΪ29��Ԫ�أ���̬ͭԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d104s1���ʴ�Ϊ��1s22s22p63s23p63d104s1��
��1mol����ɫ�����������Ϊ[Cu(NH3)4]2+�����к��е�������Cuԭ����Nԭ�Ӽ����λ���Ͱ��������еĹ��ۼ�����ĿΪ16NA���ʴ�Ϊ��16NA��
�ۼ����Ҵ��������ܼ��ļ��ԣ�������ܽ�Ƚ��ͣ���˼����Ҵ�����[Cu(H2O)4]SO4H2O�����������ʴ�Ϊ�������Ҵ��������ܼ��ļ��ԣ�������ܽ�Ƚ�����
(2)���ǻ����������γɷ�����������е㽵�ͣ����ǻ����������γɷ��Ӽ�������е����ߣ�������ǻ������ķе���ڶ��ǻ������ķе㣻�����谷�����У������ϵ�Nԭ�Ӻ���3���� ����һ���µ��Ӷԣ����Բ�ȡsp3�ӻ������ϵ�Nԭ�Ӻ���2���� ����һ���µ��Ӷԣ����Բ�ȡsp2�ӻ��� ![]() ���������漰�ĵڶ�����Ԫ��ΪC��N��O��ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�����N��2pΪ������ṹ����Ϊ�ȶ�����һ��������С�����˳��ΪC<O<N���ʴ�Ϊ�����ڣ�sp2��sp3��C<O<N��
���������漰�ĵڶ�����Ԫ��ΪC��N��O��ͬһ����Ԫ���У�Ԫ�صĵ�һ����������ԭ����������������������ƣ�����IIA�塢��VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�����N��2pΪ������ṹ����Ϊ�ȶ�����һ��������С�����˳��ΪC<O<N���ʴ�Ϊ�����ڣ�sp2��sp3��C<O<N��
(3)��CuN3�е���������CO2��Ϊ�ȵ����壬�ṹ�������̼���ƣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��CuN3����ľ������Ȼ��Ƶľ������ƣ��þ��徧���߳�a��b��c����ϵΪa=b<c�����ṹΪ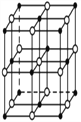 �����������������������4�����ʴ�Ϊ��4��
�����������������������4�����ʴ�Ϊ��4��
(4)��F�ĵ縺�Ա�N��N-F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ�������γ���λ������NF3������Cu2+�γ������ӣ�����ȶ���[Cu(NH3)4]2+����[Cu(NF3)4]2+���ʴ�Ϊ�����ڣ�
��N(CH3)3����ռ�ӵ���������ȶ���[Cu(NH3)4]2+����[Cu[N(CH3)3]4]2+���ʴ�Ϊ��N(CH3)3����ռ�ӵ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ����һ�����͵Ļ�ѧ��Դ���乹����ͼһ��ʾ��a��b�����缫���ɶ��̼�Ƴɣ�ͨ��������ɿ�϶���ݳ������ڵ缫����ŵ硣
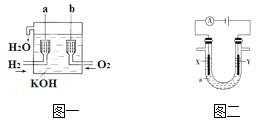
��1��a��________�����缫��Ӧʽ��_______________________��b��________�����缫��Ӧʽ��_______________________��
��2����ȼ�ϵ��������360 kg��ˮ�����·��ͨ����_____________mol�ĵ��ӡ�
��3������ͼ����ʾ��ⷽ��������ͭ�����Һaѡ��CuSO4��Һ����
��X�缫�IJ�����________���缫��Ӧʽ��___________________��
��Y�缫�IJ�����______________���缫��Ӧʽ��_____________________��(˵�������ʷ����ĵ缫��Ӧ����д��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����������������������ǣ� ��
A.��100mL����ƿ����70mL0.1mol/L����
B.��������ƽ��ȡ25.20g�Ȼ���
C.��20mL����Ͳ��ȡ13.86mL NaOH��Һ
D.����������ȵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.1mol/Lϡ�����ˮϡ�ͣ���ͼ�е�������y�����ǣ�������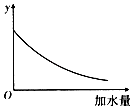
A.��Һ��pH
B.����ĵ���ƽ�ⳣ��
C.��Һ�д�������ʵ���Ũ��
D.����ĵ���̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܵ�����������Ũ��ˮ��������ܵ��Ƿ�©����ij��ѧ��ȤС��������ͼװ��̽�������백��֮��ķ�Ӧԭ��������A��F�ֱ�Ϊ�����������ķ���װ�ã�CΪ�����백���ķ�Ӧװ�á�
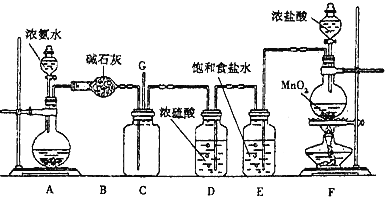
��ش��������⣺
(1)װ��A�е���ƿ�ڹ������ѡ��______(ѡ�����)��
A���������� B����ʯ�� C������������
(2)װ��F�з�����Ӧ�����ӷ���ʽΪ__________________________________��װ��E��������______________________________��
(3)ͨ��װ��C������������߽ϳ����ұ߽϶̣�Ŀ����________________________��
(4)װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ�������Ҫ�ɷ�֮һ����д����Ӧ�Ļ�ѧ����ʽ��_____________________________________________���÷�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ_________����װ��C��G���ݳ���β���п��ܺ��л���ɫ���ж����壬��δ���?__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��X��ԭ�ӣ���M����K���������ͬ��Ԫ��Y��ԭ�ӣ���L������5�����ӣ�X��Y���γɵ��ȶ��������Ħ������Ϊ�� ��
A.148gmol��1
B.100gmol��1
C.90gmol��1
D.38gmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ijBa��OH��2��Һ����μ���pH=x�����ᣬ��û����Һ�IJ���pH�����ʾ��
��� | ����������Һ�����/mL | ��������/mL | ��Һ��pH |
�� | 22.00 | 0.00 | 13 |
�� | 22.00 | 18.00 | 12 |
�� | 22.00 | 22.00 | 7 |
��1��Ba��OH��2��Һ�����ʵ���Ũ��Ϊ��
��2��x��ֵ�Ƕ��٣�
��3����100mL����Ba��OH��2��Һ����μ���0.05mol/L NaHCO3��Һ���������պô����ֵʱ��Һ��pHΪ���٣�����֪lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӣ�����ЩԪ����ɵij������ʵ�ת����ϵ����ͼ������a��b��d��gΪ��������aΪ����ɫ������c��Z�ĵ������õ������ˮ������Ӧ���Ҹõ��ʿ�������������fΪ���嵥�ʡ������й�˵����ȷ����
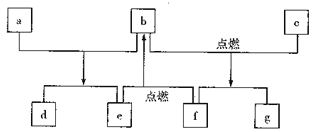
A. �����ӵİ뾶:Y>Z>X B. Ԫ�صķǽ�����:W>X
C. ����������Ӧˮ����ļ���:Y>Z D. X��Y����Ԫ����ɵĻ�����ֻ�����Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���H+��NH4+��Mg2+��Al3+��Fe3+��CO32-��SO42-��NO3-�еļ��֡���������п����������ɫ��ζ�����壻��������NaOH��Һ��������ɫ�������Ҳ����ij����������NaOH�����ʵ���֮��Ĺ�ϵ��ͼ��ʾ��������˵����ȷ����
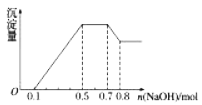
A. ��Һ��һ������NH4+ B. ��Һ��һ������Al3+
C. ��Һ��һ������NO3- D. ��Һ��һ������SO42-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com