
序号 | I1 | I2 | I3 | I4 | I5 | I6 |
电离能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
序号 | I7 | I8 | I9 | I10 | I11 | …… |
电离能 | 224.9 | 266.0 | 327.9 | 367.41 | 761 | …… |
(1)外层电子离核越远,能量越高,电离能越_______________(填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越___________________(填“大”或“小”)。
(2)上述11个电子分属几个电子层?___________________。
(3)去掉11个电子后,该元素还有___________________个电子。
(4)该元素最高价氧化物对应水化物的化学式是___________________。
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:阅读理解
| SO | 2- 3 |
| ||
| (540.0×10-10cm)3 |
| ||
| (540.0×10-10cm)3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
| 270.0 | ||
|
135.0×
| ||
sin
|
| 3 |
查看答案和解析>>
科目:高中化学 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:022
电离能是指1 mol气态原子(或阳离子)失去1 mol电子形成1 mol气态阳离子(或更高价态阳离子)所需吸收的能量.现有核电荷数小于20的元素A,其电离能数据如下(I1表示原子失去第1个电子的电离能,In表示原子失去第n个电子的电离能.单位:eV):
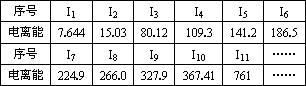
(1)外层电子离核越远,能量越高,电离能越________(填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越________(填“大”或“小”).
(2)上述11个电子分属几个电子层?________.
(3)去掉11个电子后,该元素还有________个电子.
(4)该元素最高价氧化物对应水化物的化学式是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
序号 | I1 | I2 | I3 | I4 | I5 | I6? |
电离能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
序号 | I7 | I8 | I9 | I10 | I11 | …… |
电离能 | 224.9 | 266.0 | 327.9 | 367.4 | 1 761 | …… |
根据以上信息回答:
(1)外层电子离核越远,能量越高,电离能越________(选填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越________ (选填“大”或“小”)。
(2)上述11个电子分属________个电子层。
(3)去掉11个电子后,该元素还有________个电子。
(4)该元素的最高化合价为________,最高价氧化物对应水化物的化学式是________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com