
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)用量筒量取所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(填偏高、偏低、无影响).
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是
(4)将冷却后的上述溶液沿注入中,并用50mL蒸馏水洗涤烧杯次,洗涤液也要注入容量瓶中,并摇匀.如未冷却就转移,则所配溶液的浓度会(填偏高、偏低或无影响);若未洗涤烧杯,则所配溶液的浓度会(填偏高、偏低或无影响).
(5)加水至液面距刻度线下时,改用加水,使溶液的 .
【答案】
(1)13.6
(2)15;偏低
(3)烧杯;防止浓硫酸飞溅
(4)玻璃棒;500mL容量瓶;2~3;偏高;无影响
(5)1﹣2cm;胶头滴管;凹液面正好跟刻度相平
【解析】解:(1)浓H2SO4的物质的量浓度c= ![]() =
= ![]() mol/L=18.4mol/L;根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6,所以量取的浓硫酸体积是13.6mL,故答案为:13.6; (2)所需浓硫酸的体积为13.6mL,所以选择15mL量筒,量取时发现量筒不干净,用水洗净后直接量取,将导致量筒残留一部分水,实际量取液体体积偏小,浓度偏低,故答案为:15;偏低;(3)浓硫酸稀释的方法为:稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入盛有水的烧杯中,同时用玻璃棒不断搅拌,以使热量及时地扩散,防止浓硫酸飞溅;切不可把水注入浓硫酸中;故答案为:烧杯;防止浓硫酸飞溅;(4)根据溶液的配置步骤可知,将冷却后的溶液沿着玻璃棒注入500mL容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要转移到容量瓶中,摇匀,如未冷却就转移,则所配溶液体积偏小,浓度会偏高,若未洗涤烧杯,则所配溶液的浓度无影响,故答案为:玻璃棒;500mL容量瓶;2~3;偏高;无影响;.(5)加水至距刻度1﹣2cm处,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平,摇匀,故答案为:1﹣2cm;胶头滴管;凹液面正好跟刻度相平.
mol/L=18.4mol/L;根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6,所以量取的浓硫酸体积是13.6mL,故答案为:13.6; (2)所需浓硫酸的体积为13.6mL,所以选择15mL量筒,量取时发现量筒不干净,用水洗净后直接量取,将导致量筒残留一部分水,实际量取液体体积偏小,浓度偏低,故答案为:15;偏低;(3)浓硫酸稀释的方法为:稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入盛有水的烧杯中,同时用玻璃棒不断搅拌,以使热量及时地扩散,防止浓硫酸飞溅;切不可把水注入浓硫酸中;故答案为:烧杯;防止浓硫酸飞溅;(4)根据溶液的配置步骤可知,将冷却后的溶液沿着玻璃棒注入500mL容量瓶中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要转移到容量瓶中,摇匀,如未冷却就转移,则所配溶液体积偏小,浓度会偏高,若未洗涤烧杯,则所配溶液的浓度无影响,故答案为:玻璃棒;500mL容量瓶;2~3;偏高;无影响;.(5)加水至距刻度1﹣2cm处,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平,摇匀,故答案为:1﹣2cm;胶头滴管;凹液面正好跟刻度相平.
(1)浓H2SO4的物质的量浓度c= ![]() ;根据溶液稀释前后物质的量不变即c(稀)V(稀)=c(浓)V(浓)计算所需浓硫酸的体积;(2)根据所需浓硫酸的体积选择量筒的规格,为减少误差选择略大于所需浓硫酸体积且规格相近的量筒;(3)浓硫酸溶于水放出大量的热,应防止酸液飞溅;(4)移液时用玻璃棒引流,注意冷却后再转移到容量瓶中;(5)加水至距刻度1﹣2cm处,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平.
;根据溶液稀释前后物质的量不变即c(稀)V(稀)=c(浓)V(浓)计算所需浓硫酸的体积;(2)根据所需浓硫酸的体积选择量筒的规格,为减少误差选择略大于所需浓硫酸体积且规格相近的量筒;(3)浓硫酸溶于水放出大量的热,应防止酸液飞溅;(4)移液时用玻璃棒引流,注意冷却后再转移到容量瓶中;(5)加水至距刻度1﹣2cm处,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平.


科目:高中化学 来源: 题型:
【题目】钠与下列物质反应都能够产生氢气:①H2O;②CH3COOH;③CH3CH2OH。试推断这三种物质电离出H+的难易程度(从难到易的顺序)( )
A. ①②③ B. ②③① C. ③①② D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知:
①CO(g)+0.5O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
则处理CO、SO2的方法的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为______mol,放出的热量为_____(用含有a和b的代数式表示)kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______。
(4)已知下列热化学方程式:
①![]() △H=-285.8kJ/mol
△H=-285.8kJ/mol
②![]() △H=-241.8kJ/mol
△H=-241.8kJ/mol
则H2的燃烧热(△H)为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
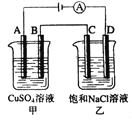
A. 甲烧杯中A极上最多可析出铜0.64g
B. 甲烧杯中B极上电极反应式4OH--4e-= 2H2O+O2↑
C. 乙烧杯中滴入酚酞试液,D极附近先变红
D. 烧杯中C极上电极反应式为4H+ + 4e-=2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,HCl作还原剂的是( )
A.NaOH+HCl═NaCl+H2O
B.Zn+2HCl═ZnCl2+H2↑
C.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl═CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.某温度时的混合溶液中c(H+)=![]() mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C.已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中能大量共存的离子组是( )
A. K+、Mg2+、MnO4﹣、Cl﹣ B. Na+、Ba2+、NO3﹣、Cl﹣
C. Na+、H+、SO42﹣、Cl﹣ D. Ca2+、K+、CO32﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾中对人体有害的主要成分有固体细颗粒、氮和硫的氧化物、芳香烃、重金属离子。下列说法不正确的是
A.苯是最简单的芳香烃
B.重金属离子可导致蛋白质变性
C.氮和硫的氧化物都属于酸性氧化物
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com