
 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.分析 A、B、C、D、E是短周期中原子序数依次增大的主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,则E为S元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于B,则C只能处于第三周期,故C为Na;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Na,故B处于第二周期,最外层电子数为4,故B为碳元素;元素A的单质在常温下呈气态,A的原子序数小于B,故A为H元素,据此解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的主族元素,元素D的合金是日常生活中常用的金属材料,则D为Al;常温常压下,E单质是淡黄色固体,常在火山口附近沉积,则E为S元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于B,则C只能处于第三周期,故C为Na;元素B的原子最外层电子数是其电子层数的2倍,原子序数小于Na,故B处于第二周期,最外层电子数为4,故B为碳元素;元素A的单质在常温下呈气态,A的原子序数小于B,故A为H元素.
(1)NaH与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑;
(2)B元素的元素符号为:C;CA为NaH,电子式为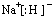 ;D为Al,在元素周期表中的位置为第三周期ⅢA族,
;D为Al,在元素周期表中的位置为第三周期ⅢA族,
故答案为:C;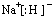 ;第三周期ⅢA族;
;第三周期ⅢA族;
(3)H2S的燃烧热△H=-a kJ•mol-1,则H2S燃烧反应的热化学方程式:H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(l)△H=-a kJ•mol-1,
故答案为:H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(l)△H=-a kJ•mol-1;
(4)甲、乙、丙分别是碳、Al、S三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同,则甲为碳酸钠、乙为偏铝酸钠、丙硫酸氢钠,
①向硫酸氢钠溶液中缓慢滴加过量的偏铝酸钠溶液,开始氢离子过量,偏铝酸根离子与氢离子反应生成铝离子,反应离子方程式为4H++AlO2-=Al3++2H2O,当氢离子反应完毕,偏铝酸根离子与铝离子发生彻底双水解生成氢氧化铝沉淀,反应离子方程式为 Al3++3 AlO2-+6H2O=4Al(OH)3↓,
故答案为:4H++AlO2-=Al3++2H2O;Al3++3 AlO2-+6H2O=4Al(OH)3↓;
②向碳酸钠溶液中缓慢滴加等物质的量的硫酸氢钠溶液,二者恰好反应:Na2CO3+NaHSO4=NaHCO3+Na2SO4.溶液为NaCHO3和Na2SO4的混合溶液,二者物质的量相等,c(Na+)>c(SO42-),HCO3-的水解程度大于电离,溶液呈碱性所以c(OH-)>c(H+),HCO3-的水解程度不大,所以c(HCO3-)>c(OH-),由于HCO3-水解,所以c(SO42-)>c(HCO3-),溶液中氢离子来源与水、碳酸氢根的电离,所以c(H+)>(CO32-).所得溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-),
故答案为:c(Na+)>c(SO42-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-);
(5)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,阳极发生反应:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑,生成难溶物R为Al(OH)3,Al(OH)3受热分解生成化合物氧化铝,反应方程式为:2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+CO2↑;2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查结构性质位置关系综合应用,涉及元素化合物推断、热化学方程式、电子式、离子浓度比较、原电池等,题目综合性较大,推断元素是解题关键,(5)中阳极反应式可以一步书写,难度中等,注意对基础知识的全面掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO能使人中毒的原理是CO能将人体血液中的Fe2+氧化 | |
| B. | 雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| C. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| D. | 利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )| 甲 | 乙 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将足量的CO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随CO2体积(已换算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法中不正确的是( )
常温下,将足量的CO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随CO2体积(已换算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法中不正确的是( )| A. | NaOH溶液的物质的量浓度为0.1mol/L | |
| B. | NaOH溶液的体积为2L | |
| C. | 当通入3.36LCO2时溶液中粒子浓度的大小关系满足c(CO32-)>c(HCO3-) | |
| D. | M、N点对应的纵坐标均大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH由大到小的顺序:②>③>① | B. | 水电离的C(H+):③>①>② | ||
| C. | C(NH4+):③>① | D. | ①②等体积混合后的溶液:C(H+)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 马铃薯淀粉含量比小麦的高 | |
| B. | 为了减肥不能吃大米、白面等主食 | |
| C. | 可以把马铃薯加工成馒头、面条、粉条等食品 | |
| D. | 马铃薯还有大量的脂肪,每天吃可以导致肥胖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用NH4Cl和Ca(OH)2制备NH3 | |
| B. | 工业上电解熔融状态的MgCl2制备Mg | |
| C. | 工业上利用合成氨实现人工固氮 | |
| D. | Na2O2用作呼吸面具的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能将钛钽铌等金属从盐溶液中置换出来 | |
| B. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| C. | 明矾可用作净水剂,但不能消毒杀菌. | |
| D. | 铁在冷的浓硫酸中钝化是物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com