
| A. | 分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢 | |
| B. | 分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少 | |
| C. | 分别配成溶液,加入澄清石灰水,比较是否有沉淀生成 | |
| D. | 分别将等质量的白色粉末加热,将产生的气体通入澄清石灰水中看是否变浑浊 |
分析 A.等量的碳酸氢钠与等体积、等浓度的盐酸反应快些;
B.碳酸钠和碳酸氢钠在等温时的溶解度的不同,碳酸氢钠的溶解度较小;
C.二者与Ca(OH)2反应,均生成白色沉淀;
D.碳酸氢钠受热分解,而碳酸钠不分解.
解答 解:A.等量的碳酸氢钠与等体积、等浓度的盐酸反应快些,可鉴别碳酸钠和碳酸氢钠,故A正确;
B.碳酸氢钠的溶解度较小,分别向等量的白色粉末中加等体积适量的水,比较固体溶解量的多少,可以鉴别二者,故B正确;
C.Na2CO3和NaHCO3均可与澄清石灰水反应产生白色沉淀,故加入澄清石灰水比较是否有沉淀生成的方法不能鉴别两白色粉末,故C错误;
D.加热碳酸氢钠分解放出CO2与澄清石灰水生成沉淀,碳酸钠加热不易分解,可以进行鉴别,故D正确,
故选C.
点评 本题考查物质的检验和鉴别,把握物质性质的差异为解答的关键,注意利用不同性质来鉴别物质,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于25% | B. | 大于25% | C. | 小于25% | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)<S(1)<S(s) | B. | S(g)>S(1)>S(s) | C. | S(g)>S(1)=S(s) | D. | S(g)>S(s)>S(1) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
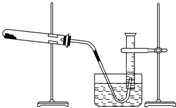 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com