
【题目】现有下列4种物质:①Na2O2、②SiO2、③SO2、④NaHCO3固体。其中,
(1)与水反应,生成能使带火星木条复燃的固体是________(填序号);
(2)能使品红溶液褪色且加热时又复原的是_________(填序号);
(3)上述物质中有1种物质难溶于水,该物质在一定条件下与焦炭发生反应,可制得电脑芯片以及太阳能电池的材料,该反应的化学方程式为:_______________________________;
(4)上述物质中有1种物质可以用来除去多余的胃酸,它还是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变疏松。写出其受热分解的化学方程式___________。
【答案】 ① ③ SiO2 + 2C ![]() Si + 2CO ↑ 2NaHCO3
Si + 2CO ↑ 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】(1)Na2O2与水反应生成NaOH和氧气,能使带火星木条复燃,故答案为:①;
(2)二氧化硫具有漂白性,能使品红溶液褪色且加热时又复原,故答案为:②;
(3)SiO2难溶于水,一定条件下与焦炭发生反应生成硅和一氧化碳,反应的化学方程式为SiO2 + 2C ![]() Si + 2CO ↑,故答案为:SiO2 + 2C
Si + 2CO ↑,故答案为:SiO2 + 2C ![]() Si + 2CO ↑;
Si + 2CO ↑;
(4)NaHCO3不稳定,加热易分解,生成碳酸钠和二氧化碳、水,碳酸氢钠能够与酸反应,用来除去多余的胃酸。碳酸氢钠受热分解的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】下列反应,其产物的颜色按红、淡黄、蓝色、浅绿色顺序排列的是( ) ①金属钠在纯氧中燃烧 ②铁与足量的稀硫酸反应 ③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中.
A.②③①④
B.③②①④
C.③①②④
D.③①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:

该有机分子的核磁共振氢谱图如下(单位是ppm):

下列关于该有机物的叙述正确的是 ( )
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸( H3BO3) 为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如右图所示( 阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
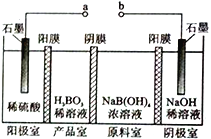
A. a 与电源的正极相连接
B. 阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C. [B(OH)4]-穿过阴膜进入产品室,Na+穿过阳膜进入阴极室
D. 当电路中通过3mol 电子时,可得到1molH3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
工业上以Ni的氧化物作催化剂,将丙烯胺氧化制得丙烯腈(CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,控制pH在8 5-9 0范围内,电解丙烯腈制己二腈、电解的总化学方程式为:4CH2=CHCN +2H2O![]() O2↑+2NC(CH2)4CN
O2↑+2NC(CH2)4CN
(1)Ni原子的核外电子排布式为____________________;在电解的总化学方程式所涉及的元素中,电负性由小到大的顺序为_________________________。
(2)PO43-的空间构型是_____________,CH2=CHCN中碳原子的杂化方式为__________________。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_________________________。
(4)已知K3PO4是离子晶体,写出其主要物理性质______________(写出2条即可)。
(5)该电解总化学方程式中各元素组成的下列物质中,存在分子内氢健的是_________(填标号)。
A.NH3 B.H2O2 C. 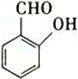 D.
D. 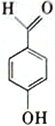
(6)金刚石的晶胞结构如右图。该晶胞中C原子数为_____________,若金刚石晶胞的密度是d g·cm-3,阿伏加德罗常数为NA,则金刚石晶胞中两个碳原子之间的最短距离为_____________。(用含d、NA的式子表示,只需要列出表达式即可)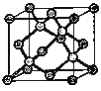
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用于合成洗涤剂、触媒及用作中间体,某学习小组在实验室用Cl2与NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。
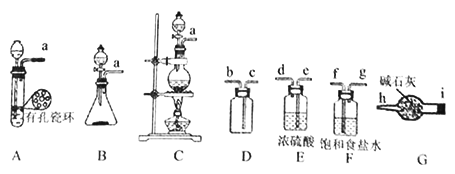
查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
请回答下列问题:
Ⅰ.Cl2的制备:舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。
(1)该方法可以选择上图中的________(填字母标号)为Cl2发生装置,该反应中被氧化与被还原物质的物质的量之比为_____________。
(2)欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a→____→i→h(按气流方向填小写字母标号)。
Ⅱ.亚硝酰氯(ClNO)的制备、实验室可用下图装置制备亚硝酰氯(ClNO):
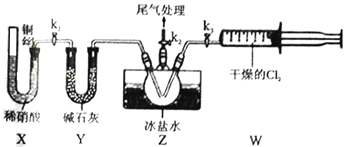
(3)实验室也可用B装置制备NO,与之相比X 装置的优点为__________________________。
(4)组装好实验装置后应先____________,然后依次装入药品、打开k2、再打开__________(填“k1”或“k3”),通入一段时间气体,其目的是为了排尽三颈烧瓶中的空气,防止NO、ClNO 变质。接下来,两种气体在Z中反应的现象为________________________________。
III.亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.8mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 22.50mL。(已知:AgCrO4为砖红色固体)
(5)亚硝酰氯(ClNO)与水反应的化学方程式为_________________________。
(6)亚硝酰氯(ClNO)的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
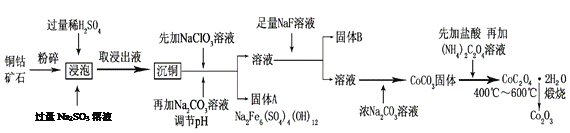
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
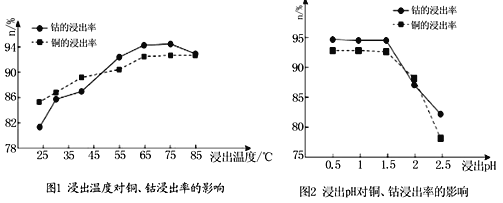
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2 ![]() C6 +LiCoO2
C6 +LiCoO2
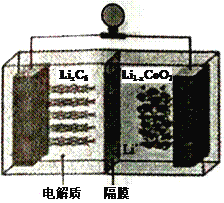
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。下列说法不正确的是
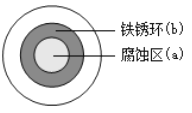
A. 铁片腐蚀过程发生的总化学方程式为:4Fe+6H2O+3O2 ==4 Fe(OH)3
B. 液滴之下氧气含量少, 铁片作负极,发生的氧化反应为: Fe-3e-=Fe3+
C. 液滴边缘是正极区,发生的电极反应为: O2+2H2O+4e-=4OH-
D. 铁片腐蚀最严重区域不是生锈最多的区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com