
| A����Ԫ�ص�ͬ�����Ԫ�ص�ԭ�ӣ�������������ͬ������ѧ���ʲ���ܴ� |
| B����Ԫ��λ�ڳ����ڣ��Ҹ���������32��Ԫ�� |
| C����Ԫ�ص����������������ӹ��� |
| D����Ԫ��Ϊ53��Ԫ�أ������ԭ����Ϊ127�����Ԫ�ص�һ��ԭ���бض�����74������ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
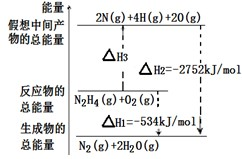
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢۢ� | B���٢ڢۢܢ� |
| C���ۢ� | D���٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������Cl2����ˮ����ʹ�ʻ���ɫ |
| B�����ˮ��ͨ��SO2����ˮ��ɫ˵��SO2����Ư���� |
| C����FeBr2��Һ�еμ�������ˮ����Һ��dz��ɫ����Ϊ������Br2 |
| D����Cl2ͨ��AgNO3��Һ�в����г������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ʱ��ij��Һ����ˮ���������c��H+����c��OH-���ij˻�Ϊ1��10-24������Һ��һ�����Դ�������K+��Na+��AlO2-��SO42- | ||
B������ʱ��0.1mol/L HA��Һ��pH��1��0.1mol/L BOH��Һ��
| ||
C������SO2ͨ�뵽Ba��NO3��2��Һ�У���ȷ�����ӷ�Ӧ����ʽΪ��3SO2+2NO3-+Ba2++2H2O�TBaSO4��+2NO��+4H++2S
| ||
| D�������£�ϡ��0.1mol/L�İ�ˮ����Һ��c��OH-����c��NH4+����c��H+�����½� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������������ |
| B��������������ʵ���֮��Ϊ16��2��1 |
| C����������ѹǿ��Ϊ16��8��1 |
| D�������������Ϊ1��8��16 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
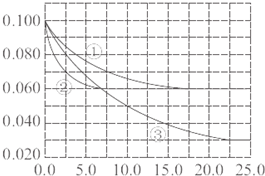 ��һ���¶��£���1molCO��3molH2�������һ���������ܱ������У��ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��=CH3OH��g��
��һ���¶��£���1molCO��3molH2�������һ���������ܱ������У��ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��=CH3OH��g��| ʵ���� | T���棩 | n��CO��/n��H2�� | p��MPa�� |
| �� | 150 | 1/3 | 0.1 |
| �� | 5 | ||
| �� | 350 | 5 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com