
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| A、CH3COONa溶液中 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、NaHS溶液中:c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 1、欲用98%的浓硫酸(ρ=1.84g?cm-3)配制成浓度为0.25mol?L-1的稀硫酸500mL.
1、欲用98%的浓硫酸(ρ=1.84g?cm-3)配制成浓度为0.25mol?L-1的稀硫酸500mL.| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
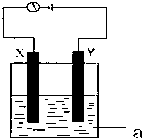 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
4 | ⑩ | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、野火烧不尽,春风吹又生 |
| B、爆竹声中一岁除,春风送暖入屠苏 |
| C、粉身碎骨浑不怕,要留清白在人间 |
| D、春蚕到死丝方尽,蜡炬成灰泪始干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
226 88 |
224 88 |
226 88 |
| A、镭的金属性比钙强,镭是第七周期Ⅱ族元素 | ||||
B、
| ||||
| C、镭单质能与水反应,放出氢气,生成的Ra(OH)2是一种两性氢氧化物 | ||||
D、Ra的碳酸盐难溶于水,
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com