
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。

(1) 已知:CH4 、CO, 、H2的燃烧热分别为890. 3 KJ·mol-1、283. 0 KJ·mol-1、285. 8 KJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)![]() 2CO(g)+4H2(g)的△H=_________
2CO(g)+4H2(g)的△H=_________
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:


①用H2表示的前2h的平均反应速率v(H2)=_________
②该温度下,CO2的平衡转化率为______________
(3)在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g)![]() C2H4 (g)+4H2 O(g) △H。在0 .1 MPa时,按
C2H4 (g)+4H2 O(g) △H。在0 .1 MPa时,按![]() (CO2):
(CO2):![]() (H2)=1:3投料,如图所示为不同温度(
(H2)=1:3投料,如图所示为不同温度(![]() )下,平衡时四种气态物质的物质的量(
)下,平衡时四种气态物质的物质的量(![]() )的关系。
)的关系。
①该反应的△H_______0(填“>”或“<”)。
②曲线![]() 表示的物质为______(填化学式)。
表示的物质为______(填化学式)。
【答案】-71.4 kJ·mol-1 0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1 40% ![]() < C2H4
< C2H4
【解析】
(1)根据CH4、、CO和H2的燃烧热分别写出燃烧的热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJmol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1,
③O2(g)+2H2(g)=2H2O(l)△H=-571.6kJmol-1;
根据盖斯定律计算得到所需热化学方程式;
(2) ①恒温恒容时,气体的压强之比等于其物质的量之比,2h时![]() =0.85,求出氢气转化量,进一步求出用氢气表示的反应速率;
=0.85,求出氢气转化量,进一步求出用氢气表示的反应速率;
②该温度下,反应进行5h时达到平衡状态,此时![]() =0.80,求出二氧化碳转化量,进一步求出CO2的平衡转化率;
=0.80,求出二氧化碳转化量,进一步求出CO2的平衡转化率;
(3)根据已知条件,列三行式,求出平衡时各气体成分所占的物质的量的分数,求出分压,进而计算平衡常数;
(4)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,C2H4(g)、H2O(g)都是生成物,随着平衡逆向移动,二者的物质的量逐渐减小,由计量数关系可知曲线b代表水,曲线c代表C2H4。
(1)根据CH4、、CO和H2的燃烧热分别写出燃烧的热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJmol-1;
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1,
③O2(g)+2H2(g)=2H2O(l)△H=-571.6kJmol-1;
利用盖斯定律将①![]() 2-②-③×2可得:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71.4kJmol-1,
2-②-③×2可得:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71.4kJmol-1,
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-71.4kJmol-1;
(2) ①恒温恒容时,气体的压强之比等于其物质的量之比,2h时![]() =0.85,设消耗CO2的物质的量为xmol,
=0.85,设消耗CO2的物质的量为xmol,
CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g) ![]() V
V
1 3 1 1 2
xmol 2x mol
则有![]() =0.85,解得x=0.3,
=0.85,解得x=0.3,
故前2h的平均反应速率v(H2)=![]() =0.225 mol·L-1·h-1。
=0.225 mol·L-1·h-1。
②该温度下,反应进行5h时达到平衡状态,此时![]() =0.80,设消耗CO2的物质的量为ymol,则有
=0.80,设消耗CO2的物质的量为ymol,则有![]() =0.85,解得y=0.4,
=0.85,解得y=0.4,
故CO2的平衡转化率为![]() ×100%=40%,
×100%=40%,
故答案为:0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1 ;40%;
(3)设开始时投入CO2和H2的物质的量分别为1mol、3mol,CO2的平衡转化率为50%,则有:
CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g)。
CH3OH(g)+ H2O(g)。
起始量/mol 1 3 0 0
转化量/mol 0.5 1.5 0.5 0.5
平衡量/mol 0.5 1.5 0.5 0.5
平衡时p(CO2)=8 MPa×![]() =
=![]() MPa, p(H2)=8 MPa×
MPa, p(H2)=8 MPa×![]() =4 MPa,p(CH3OH)=8 MPa×
=4 MPa,p(CH3OH)=8 MPa×![]() =
=![]() MPa,p(H2O)=8 MPa×
MPa,p(H2O)=8 MPa×![]() =
=![]() MPa,
MPa,
故该反应条件下的平衡常数为Kp=![]() =
=![]() =
=![]() 。
。
故答案为:![]() ;
;
(4)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,ΔH<0。
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,C2H4(g)、H2O(g)都是生成物,随着平衡逆向移动,二者的物质的量逐渐减小,由计量数关系可知曲线b代表水,曲线c代表C2H4。
故答案为:< ;C2H4。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:H2(g)+O2(g)H2O(g),反应过程中能量变化如图所示,则:
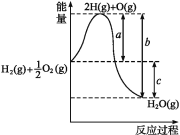
①a、b、c分别代表什么意义?a_;b_;c_。
②该反应是_反应(填“吸热”或“放热”),ΔH_0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是__________。(请写两条)
(3)已知:H2(g)+O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
H2(g)H2(l) ΔH=-0.92 kJ·mol-1
O2(g)O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成糖原和核酸的化学元素分别是
A. C H O N和C H O N P S
B. C H O和C H O N P
C. C H O P和C H O N S
D. C H O S和C H O N S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将打磨后的镁条放人盛有50 mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中的pH和浊度随时间的变化(如图所示,实线表示溶液pH随时间的变化)。下列有关描述正确的是( )
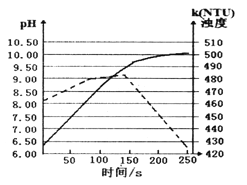
A. 该温度下Mg(OH)2的KSP的数量级约为10-10。
B. 该实验是在常温下进行的
C. 50 s时向溶液中滴人酚酞试液,溶液变红
D. 150 s后溶液浊度下降是因为生成的Mg(OH)2逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用人工模拟光合作用合成甲酸的原理为:
2CO2+2H2O![]() 2HCOOH+O2,装置如图所示,
2HCOOH+O2,装置如图所示,
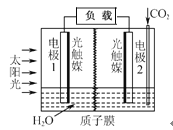
下列说法不正确的是
A.电极1周围pH增大
B.电子由电极1经过负载流向电极2
C.电极2的反应式:CO2+2H++2e-=HCOOH
D.该装置能将太阳能转化为化学能和电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
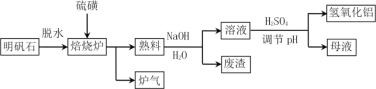
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S ![]() 2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
2Al 2O3 +9SO2,该反应的氧化剂是______________,若生成1molAl2O3,则转移的电子数为____________________。
(2)将标况下1.12L炉气通入100mL 0.5mol·L-1 NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为___________________________________。
(3)熟料溶解时反应的离子方程式为_________________________。
(4)母液中溶质主要成分的化学式为____________、_____________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:a X(g)+b Y(g) ![]() c Z(g) +d W(g) 反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
c Z(g) +d W(g) 反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述不正确的是
A. 平衡向逆反应方向移动 B. (a+b)>(c+d)
C. Z的物质的量变小 D. X的转化率变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com