
| A、加入少量盐酸,观察现象 |
| B、加入澄清石灰水,观察现象 |
| C、加入氯化钡溶液,观察现象 |
| D、通适量CO2气体,观察现象 |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
| A、宇宙飞船中使用的碳纤维,是一种新型无机非金属材料 |
| B、氢氧化铁溶胶、含塑化剂的白酒、含有细菌的矿泉水均具有丁达尔效应 |
| C、“地沟油”经过加工处理后,可以用于制肥皂和生物柴油 |
| D、化石燃料的大量使用是产生PM2.5的主要原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4LNO2含有2NA 个氧原子 |
| B、0.1mol?L-1的NaNO3溶液中含有0.1NA 个NO3- |
| C、常温下,34gNH3含有6NA 个N-H共价键 |
| D、1mol Fe2+与足量的Cl2反应,转移2NA 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组合 分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 纯碱 | 盐酸 | 烧碱 | 氧化铝 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 氧化铁 | 二氧化氮 |
| C | 苛性钠 | 石炭酸 | 硫酸铵 | 过氧化钠 | 二氧化硅 |
| D | 苛性钾 | 硬脂酸 | 小苏打 | 氧化钙 | 五氧化二磷 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石与盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、氢氧化钡与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| C、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、碳酸钠与石灰水反应:Ca2++CO32-?=CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
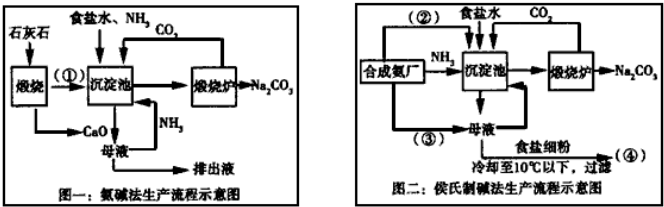
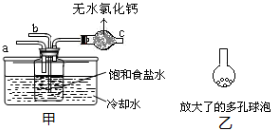
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol?L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com