
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,下列说法正确的是
A.改变压强,平衡不发生移动,反应放出的热量不变
B.加入催化剂,改变了反应的途径,反应的△H也随之改变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | K值不变,平衡可能移动 | |
| B. | 平衡向右移动时,K值不一定移动 | |
| C. | K值有变化,平衡一定移动 | |
| D. | 相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于电解质的叙述中,正确的是
①硫酸银在水中的溶解度很小,其溶液的导电能力很弱,所以硫酸银是弱电解质
②碳酸钙在水中的溶解度虽小,但溶解的部分全部电离,所以碳酸钙是强电解质
③氨气的水溶液导电性很好,所以它是强电解质
④水难电离,纯水几乎不导电,所以水是弱电解质
A.② B.① C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
在一定温度下,有a盐酸 b、硫酸 c、醋酸三种酸:
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是 。(填序号,下同)
(2)同物质的量浓度的三种酸,中和相同物质的量的NaOH溶液所需酸的体积由大到小的顺序是 。
(3)若三者c(H+)相同时,物质的量浓度大小的顺序是 。
(4)若三者c(H+)相同,体积也相同时,分别放入足量的且同样的锌,相同状况下产生气体的体积由大到小的顺序是 ,生成同体积的气体所需时间由大到小的顺序是 。
(5)将c(H+)相同的三种酸均加水稀释到原来的100倍时,c(H+)由大到小的顺序是
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
常温下,下列各组比值为1∶2的是
A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比
B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+) 之比
之比
C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
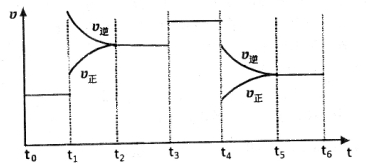
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
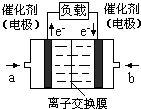 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
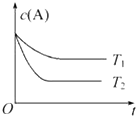 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (O2)=0.0125 mol•(L•s)-1 | B. | v (NO)=0.01mol•(L•s)-1 | ||
| C. | v (H2O)=0.12 mol•(L•s)-1 | D. | v(NH3)=0.1 mol•(L•s)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com