
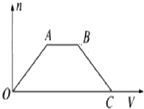
 将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )
将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图,图中AB段表示的离子方程式是( )| A. | ②⑤ | B. | ⑤④ | C. | ④② | D. | ④① |
分析 向NaOH和Ba(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故OA发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,AB之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,BC之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2,以此来解答.
解答 解:向NaOH和Ba(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故OA发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,AB之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,BC之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2,
则AB段表示的离子方程式为CO2+2OH-═CO32-+H2O、CO32-+CO2+H2O═2HCO3-,
故选A.
点评 本题考查离子反应的先后顺序,为高频考点,把握发生的反应的先后顺序及反应与图象的对应关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | CH2=CH3 | B. | CH2=CH-CH2OH | C. | CH3=CH-COOH | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼铜时,粗铜作阴极、精铜作阳极 | |
| B. | 在镀件上电镀铜时,用金属铜作阳极 | |
| C. | 在电解池中,铜作电极时,溶液中的阴离子在铜极上失电子 | |
| D. | 电解饱和食盐水制稀硫酸制Cl2、H2时,可用金属铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 $\stackrel{(1)O_{2}(2)Zn/H_{2}O}{→}$
$\stackrel{(1)O_{2}(2)Zn/H_{2}O}{→}$ +
+ (R1、R2、R3、R4为H或烷基)
(R1、R2、R3、R4为H或烷基)| A. | (CH3)2C=C(CH3)2 | B. |  | C. |  | D. | CH2=CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2 | B. | NO | C. | N2 O | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
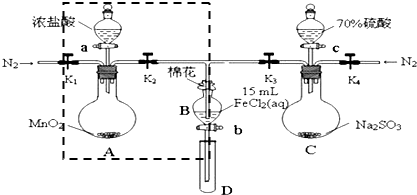
| 过程⑤B溶液中含有的离子 | 过程⑦B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
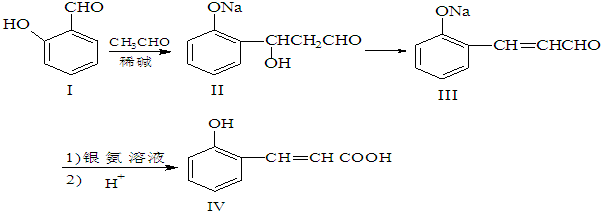
 ;
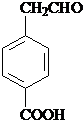
;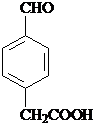 、
、
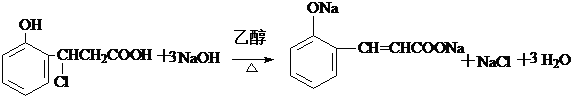 或
或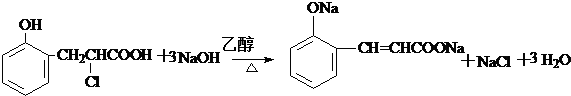 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com