
 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:
根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池如图所示:分析 根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池,Zn失电子作负极,Cu为正极,正极上氢离子得电子,电子从负极流向正极,电流从正极流向负极,结合电子与物质的关系计算.
解答 解:(1)根据氧化还原反应Zn+2H+═Zn2++H2↑设计的原电池,Zn失电子作负极,负极反应为Zn-2e-=Zn2+;Cu为正极,正极上氢离子得电子生成氢气,则正极反应为2H++2e-=H2↑;
故答案为:负;Zn-2e-=Zn2+;正;2H++2e-=H2↑;
(2)外电路中,电子的流向从Zn电极向Cu电极;电流的流动方向由Cu电极流向 Zn电极;
故答案为:Zn;Cu;Cu;Zn;
(3),负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,当电路中转移0.2mol的电子时,消耗的Zn为0.1mol,则锌的质量为6.5g,生成的氢气为0.1mol,其体积为2.24L;
故答案为:6.5g;2.24L.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式为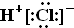 | B. | Cl-的结构示意图 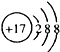 | ||
| C. | CO2的电子式 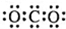 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | KHCO3?K++H+++CO3- | D. | CH3COONH4=NH4++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲醛 | B. | 乙醛 | C. | 丁醛 | D. | 戊醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:
某校开展课外研究性学习:从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个过程如下,回答有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com