
根据最新报道,科学家发现了如下反应O2+ PtF6 = O2(PtF6),已知O2 (PtF6)为离子化合物(其中Pt为+5价),对于此反应,下列说法正确的是:
A、在此反应中, O2氧化剂,PtF6是还原剂
B、 O2 (PtF6)中氧元素的化合价为+1价
C、在此反应中,每生成1 mol O2 (PtF6) 则转移1 mol电子
D、在O2 (PtF6)中不存在共价键
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
 (2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
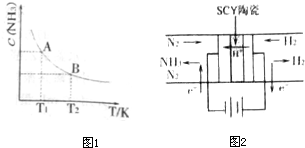
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?石家庄模拟)科学家一直致力于“人工固氮”的方法研究.
(2012?石家庄模拟)科学家一直致力于“人工固氮”的方法研究.| 7 |
| 8 |
| C4(NH3)C3(O2) |
| C2(N2)C6(H2O) |
| C4(NH3)C3(O2) |
| C2(N2)C6(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| H | + 4 |
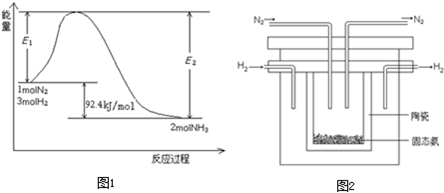
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com