
分析 ①周期表中有7个横行就有7个周期,有18个纵行,有16个族;
②非金属元素(不包括稀有气体元素)全是主族元素;
③周期表中第三纵行至第十纵行包括部分副族、Ⅷ族元素;
④He原子只有2个电子;
⑤第IA族元素包括氢元素、碱金属元素;
⑥副族元素全是金属元素;
⑦短周期元素是第一、二、三周期元素;
⑧周期表中每周期元素都是从第IA族开始,至零族结束;
⑨一种核素就是一种原子,也是一种元素;
⑩互称同位素的原子质子数相同,一定是同种元素,肯定不是同种核素.
解答 解:①周期表中有7个横行就有7个周期,有18个纵行,有7个主族、7个副族、1个零族、1个第Ⅷ族,共有有16个族,故错误;
②非金属元素(不包括稀有气体元素)全是主族元素,故正确;
③周期表中第3-7列分别为ⅢB-ⅦB族,而8、9、10三列为第Ⅷ族,故错误;
④He原子只有2个电子,最外层不满足8电子结构,故错误;
⑤第IA族元素除碱金属元素外,还包括氢元素,故错误;
⑥副族元素全是金属元素,故正确;
⑦短周期元素是第一、二、三周期元素,而19、20号元素为第四周期元素,故错误;
⑧周期表中每周期元素都是从第IA族开始,至零族结束,故错误;
⑨一种核素就是一种原子,也是一种元素,故正确;
⑩互称同位素的原子质子数相同,一定是同种元素,中子数不同,肯定不是同种核素,故正确,
故答案为:②⑥⑨⑩.
点评 本题考查元素周期表、同位素、核素、元素等,比较基础,注意对基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 用量筒、试管、胶头滴管、玻璃棒、蒸馏水和 pH试纸,可鉴别pH 相等的硫酸和醋酸 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定不存在Ag+和NO3- | B. | 一定存在CO32- | ||
| C. | 一定存在NO3-和Cl- | D. | 一定不存在NO3-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 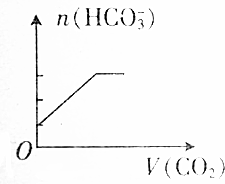 | B. | 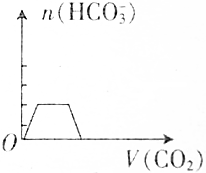 | ||
| C. | 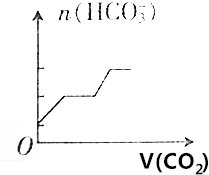 | D. | 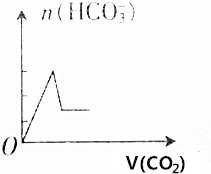 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液一定含有Fe2+ | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
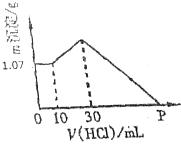 把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求
把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 108g | B. | 54g | C. | 216g | D. | 64g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键 | |
| B. | 不同元素的原子构成的分子不一定只含极性共价键 | |
| C. | 含极性键的共价化合物一定是电解质 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl更稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com