
【题目】亚硝酸钠(NaNO3)是工业盐的主要成分,在漂白、电镀等方面应用广泛。己知: 室温下,2NO+Na2O2= =2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(部分夹持装置已略去)下列说法正确的是
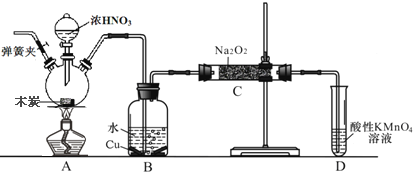
A. 实验开始前先向装置中通入N2,实验结束时先停止通入N2再熄灭酒精灯
B. 可以将B中药品换成NaOH 溶液
C. 应在B、C之间加一个盛放碱石灰的干燥管
D. D装置用于尾气处理,标况下,每吸收11.2L的尾气消耗0.2mol 的高锰酸钾
【答案】C
【解析】A. 以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠,由于该实验中有气体参加,所以在组装好仪器后首先要检查装置的气密性,再装药品,由于实验过程中有一氧化氮产生,所以要将装置中的空气全部排尽,再进行实验,实验结束时先熄灭酒精灯,再停止通入N2,可以防止倒吸等意外事故的发生,故A错误;B. 若将B中药品换成NaOH 溶液,二氧化氮与氢氧化钠反应,没有NO放出,故B错误;C. 因为一氧化氮中混有二氧化碳和水蒸气,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,故应在B、C装置间增加一个盛放碱石灰的干燥管,以除去NO中的杂质气体,故C正确;D. 酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+,D装置用于尾气处理,标况下,11.2LNO的物质的量等于0.5mol,根据得失电子守恒,消耗的高锰酸钾为![]() =0.3mol,故D错误;故选C。
=0.3mol,故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化: 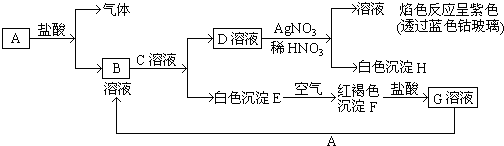
试回答:
(1)写出B的化学式D的化学式 .
(2)写出由E转变成F的化学方程式 .
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法,不正确的是

A. 甲图四种化合物中“0”内A所对应含义的解释有一个是错误的
B. 硝化细菌体内含有甲图中的四种化合物
C. 若乙图表示某种酶在不同温度下催化某反应的效果图,则温度a>b>c
D. 若乙图表示不同浓度的某种酶催化某反应的效果图,则酶浓度a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾因可能致癌而陷舆论风波的除草剂一一草甘膦已于2017 年11月被相关部门正式批准可继续使用,其结构如图所示,下列说法不正确的是

A. 1mol 的草甘膦可以与3mol 的NaOH中和
B. 分子式为C3H8NO5P
C. 可以溶于水
D. 属于酯类的同分异构体只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知: N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=﹣534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
A.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣542.7 kJ/mol
B.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1059.3 kJ/mol
C.N2H4(g)+ ![]() N2O4(g)═
N2O4(g)═ ![]() N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z、T 的原子序数依次增大,由这五种元素组成一种复盐(含2 种阳离子和1种阴离子的盐) M。M 中阳离子和阴离子总数相等。取少量M 溶于水,将所得溶液分成两份:一份滴加氯化钡溶液和盐酸,产生白色沉淀;另一份滴加氢氧化钠溶液,先产生白色沉淀,继续滴加则白色沉淀消失,反应过程中产生有刺激性气味的气体。下列说法正确的是
A. R、X 可以形成X2R4,电子式为![]()
B. 气态氢化物的稳定性: XH3>H2Y>H2T
C. Y 和Z形成的氧化物常作为除去A1Cl3溶液中少量的Fe3+的沉淀剂
D. M 的水溶液中离子浓度大小排序为:c(SO42-) >c(Al3+) > c(NH4+) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、A12O3和Fe2O3等,回收其中镁的工艺流程如下:

沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH 由见上表
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有_____________________(要求写出两条)
(2)滤渣I的主要成分有_________________________。
(3)从滤液II中可回收利用的主要物质有________________________。
(4)若最终得到的氯化镁溶液中,c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1 ,此时是否有Mg3(PO4)2沉淀生成?_______(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(5) Mg (C1O3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaC1O3=Mg (C1O3)2+2NaCl已知四种化合物的溶解度(S) 随温度(T) 变化曲线如下图所示: ①将反应物按化学反应方程式计量数比混合制备Mg (ClO3)2。简述可制备Mg (ClO3)2的原因:_______________________。
②按①中条件进行制备实验。在冷却降温析出Mg (ClO3)2过程中,常伴有NaCl 析出,原因是:__________。除去产品中该杂质的方法是:___________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A. ①④ B. ②③
C. ①③④ D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com