
分析 钼(Mo)的晶胞为体心立方晶胞,一个晶胞中含有钼原子数为1+8×$\frac{1}{8}$=2,金属钼原子为等径的刚性球且处于体对角线上的三个球相切,钼原子的半径为晶胞体对角线的$\frac{1}{4}$,所以晶胞的边长为$\frac{4}{\sqrt{3}}a$pm,根据$ρ=\frac{m}{V}$求得晶胞的密度.
解答 解:钼(Mo)的晶胞为体心立方晶胞,一个晶胞中含有钼原子数为1+8×$\frac{1}{8}$=2,金属钼原子为等径的刚性球且处于体对角线上的三个球相切,钼原子的半径为晶胞体对角线的$\frac{1}{4}$,所以晶胞的边长为$\frac{4}{\sqrt{3}}a$pm,则$ρ=\frac{m}{V}$=$\frac{\frac{2M}{{N}_{A}}}{(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}}$g/cm3=$\frac{2M}{(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}{N}_{A}}$g/cm3,
故答案为:$\frac{2M}{(\frac{4}{\sqrt{3}}a×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题考查了晶胞的计算,比较简单,解题时要运用好基本公式及用均摊法计算,答题的难点是对对晶胞的空间结构的想象.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | H2C═CH2+H2$\stackrel{催化剂}{→}$H3C-CH3 | |
| B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | |
| C. | 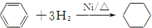 | |
| D. | 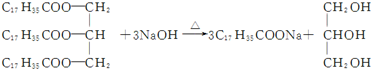 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
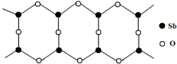

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com