
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A. 18 g H2O所含的分子数为NAB. 22.4 L H2O所含的分子数为NA
C. NA个氢原子的质量为2 gD. 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl﹣
科目:高中化学 来源: 题型:
【题目】下表各组物质中,物质之间不可能实现如图 ![]() 所示转化的是( )
所示转化的是( )
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫和二氧化碳的下列说法中不正确的是( )
A. 都是酸性氧化物B. 都具有氧化性
C. 都能使澄清石灰水变浑浊D. 都能与氯化钙溶液反应生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究钠、铁、铜及其化合物具有重要意义。
(1)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐渐加入的0.1mol/L盐酸,产生的气体CO2体积(标准状况下) 与所加入的盐酸的体积之间的关系如图所示:
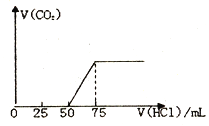
试计算:
(1)向NaOH 溶液中通入CO2气体后,所得溶液中的溶质是_______,反应产生的CO2气体体积(标准状况) 是_______L。
(2)向Ba (OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出发生反应的离子方程式_______________,若在上述反应后溶液中继续滴加NaHSO4溶液,写出此步反应的离子方程式: _______________ 。
(3)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。某厂废弃液中,含有2%~5%的NaNO2 直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是_____。
A.KMnO4 B.NH4Cl C.O2 D.HNO3
(4)向含Fe(NO3)3、 Cu(NO3)2、HNO3 的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。
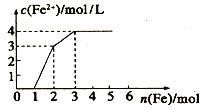
①横坐标0~1段反应的离子方程式为:_____________。
②忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.5L的恒容密闭容器中发生反应:CO2(g)+H2S(g)COS(g)+H2O(g)
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
Ⅱ | 607 | 0.22 | 0.82 | / | |
Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10﹣3 |
下列说法正确的是( )
A.该反应正反应为放热反应
B.607K时该反应的平衡常数为2.50×10﹣3
C.容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A.乙醇不能发生取代反应
B.C4H10有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:

(1)“反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 __。
(2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为__。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为__。
(4)“反应Ⅲ”的离子方程式为___。
(5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为___。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 2Fe+3Cl2![]() 2FeCl3 Cu+2H2SO4 (浓)
2FeCl3 Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO
CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO![]() +4H+ Cl2+SO2+2H2O=4H++SO
+4H+ Cl2+SO2+2H2O=4H++SO![]() +2Cl-
+2Cl-
【解析】(1)MnO2与浓盐酸反应生成MnCl2和Cl2,Mn元素化合价由+4价降低为+2价,盐酸中Cl元素化合价降为0价,根据元素守恒,反应有水生成,可得MnO2+HCl(浓) —MnCl2+Cl2↑+H2O,根据化合价升降守恒配平方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)粗铜中含有少量铁,通入Cl2,将Cu氧化为CuCl2,将Fe氧化为FeCl3,生成FeCl3的反应方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)铜和浓硫酸反应制SO2,反应方程式为Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)将CuCl2、FeCl3固体溶解后,再将铁离子转化为红褐色的氢氧化铁沉淀,过滤除铁,得到溶液CuCl2。向溶液中通入SO2,生成目标产物CuCl,Cu元素化合价降低,被还原,则SO2被氧化为SO42-,离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(5)若将等物质的量的SO2、Cl2通入水中,恰好完全反应生成硫酸和盐酸,所得溶液没有漂白性,离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-。
【题型】综合题
【结束】
23
【题目】有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,为黑色磁性氧化物, E为常见的强碱。

(1)D的化学式为__。
(2)写出反应①的离子方程式:__。
(3)写出反应②的离子方程式:__。
(4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com