
11分)如图是某同学设计的放热反应的观察装置,其实验操作是: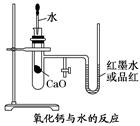
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液)打开T形管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹;
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,即可观察.
试回答:
(1)实验中观察到的现象是 。
(2)该实验中必须进行的一步实验操作是 。
(3)该实验的原理是 。
(4)实验中发生的化学反应方程式: 。
(5)说明CaO、H2O的能量与Ca(OH)2能量之间的关系: 。
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象? (填“能”或“否”).
(1) U形管内的红墨水(或品红溶液)沿开口端升高。 (2) 检查装置的气密性。(3) CaO与 H2O反应使管内的气体膨胀,引起U形管内红墨水(或品红溶液)的液面左低右高。(4) CaO+ H2O===Ca(OH)2(5) CaO、H2O的总能量大于Ca(OH)2能量(6) 否
解析试题分析:CaO和H2O放出大量的热,使得试管内的气体受热膨胀,气压增大,将左边的红墨水往右边压,红墨水的液面就左低右高。(1) 实验中观察到的现象是U形管内的红墨水(或品红溶液)沿开口端升高。(2)该实验与气体有关,故装置气密性一定要好,实验前一定要检查装置的气密性;(3)实验原理是CaO与H2O反应使管内的气体膨胀,引起U形管内红墨水(或品红溶液)的液面左低右高。(4) 反应方程式为:CaO+ H2O===Ca(OH)2(5)反应是放热反应,故 CaO、H2O的总能量大于Ca(OH)2能量。(6) NaCl和H2O混合没有明显放热,不能是试管内的气压增大,看不到CaO实验中的形象。
考点:反应的热量变化和在实验中的应用。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:实验题
(10分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”)。
(3)他们记录的实验数据如下:已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18kJ·℃-1· kg-1,各物质的密度均为1g·cm-3。①计算完成下表。(保留小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将 (填“变大”或“变小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某食用白醋是由醋酸与纯水配制而成,用0.1000 mol/L NaOH溶液准确测定其中醋酸的物质的量浓度。以下为某同学列出的实验步骤(未排序),请回答下列问题。
| A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm |
| B.调节滴定管液面至0或0刻度以下,记下读数 |
| C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度 |
| D.用标准液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次 |
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH) /mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH) /mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com