
【题目】烃A是一种重要的有机化工原料,其相对分子质量Mr(A),90<Mr(A)<110。取一定量A在足量氧气中完全燃烧后,生成的CO2和H2O的物质的量之比为2:1;A能使溴的四氯化碳溶液褪色,红外光谱显示A分子中有苯环。有机物间的转化关系如图:
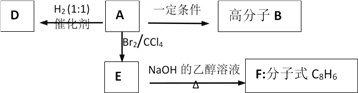
(1)A的实验式为_________;A的相对分子质量为_________;A的官能团的名称为_______________。
(2)A→B的反应方程式为______________________________________。反应类型为______________。
(3)用有机物D的同系物制取炸药TNT的反应方程式为______________________________________。
(4)E→F的反应方程式为__________________________________________。
(5)有机物甲为A的同系物,符合下列两个条件的甲的结构有____种(包括立体异构)。
① 甲的相对分子质量比A大14,②苯环上只有一条侧链。 其中核磁共振氢谱有五组峰,峰面积之比为1:2:2:2:3的物质结构简式为_________________。
【答案】 CH 104 碳碳双键 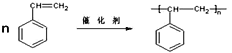 加聚反应
加聚反应 
![]() +2NaOH
+2NaOH![]()
 +2NaBr+2H2O 4
+2NaBr+2H2O 4 ![]()
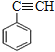
【解析】一定量A在足量氧气中完全燃烧后,生成的CO2和H2O的物质的量之比为2:1;则A中C和H的个数比为1:1,最简式为CH,设A的分子式为CxHx。因为90<Mr(A)<110,则90<13x<110,解得x=7或8,烃中氢原子数目不可能为奇数,C7H7舍去,因此A的分子式为C8H8,A能使溴的四氯化碳溶液褪色,红外光谱显示A分子中有苯环,因此A为苯乙烯(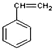 )。根据流程图,B为聚苯乙烯(
)。根据流程图,B为聚苯乙烯(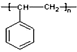 ),E为
),E为![]() ,F为苯乙炔,D为乙苯。
,F为苯乙炔,D为乙苯。
(1)根据上述分析,A的实验式为CH;A的相对分子质量为13×8=104;A的官能团为碳碳双键,故答案为:CH;104;碳碳双键;
(2)A→B是苯乙烯发生的加聚反应,反应的反应方程式为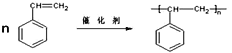 ,故答案为:
,故答案为: ;加聚反应;
;加聚反应;
(3)D为乙苯,用乙苯的同系物制取炸药TNT,该同系物为甲苯,反应方程式为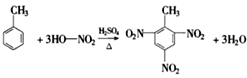 ,故答案为:
,故答案为: ;
;
(4)E→F是卤代烃的洗气反应,反应的方程式为![]() +2NaOH
+2NaOH![]()
 +2NaBr+2H2O,故答案为:
+2NaBr+2H2O,故答案为:![]() +2NaOH
+2NaOH![]()
 +2NaBr+2H2O;
+2NaBr+2H2O;
(5)A为苯乙烯( ),有机物甲为A的同系物。① 甲的相对分子质量比A大14,②苯环上只一条侧链,则满足条件的甲的侧链结构有—CH=CHCH3,—C(CH3)=CH2,—CH2CH=CH2,其中—CH=CHCH3存在立体异构,共4种结构;其中核磁共振氢谱有五组峰,峰面积之比为1:2:2:2:3的物质结构简式为
),有机物甲为A的同系物。① 甲的相对分子质量比A大14,②苯环上只一条侧链,则满足条件的甲的侧链结构有—CH=CHCH3,—C(CH3)=CH2,—CH2CH=CH2,其中—CH=CHCH3存在立体异构,共4种结构;其中核磁共振氢谱有五组峰,峰面积之比为1:2:2:2:3的物质结构简式为![]() ,故答案为:4;
,故答案为:4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是
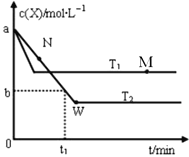
A. M点的 v正小于N点的v逆
B. M点时,升高温度平衡逆向移动
C. T2下,在0-t1时间内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. W点时再加入一定量Y,平衡后Y的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如题21图。下列有关说法正确的是
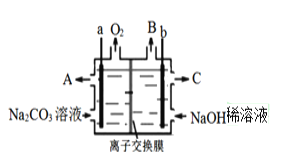
A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为4CO32-+2H2O-4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的SO42―离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《中国诗词大会》不仅弘扬了中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“ 乌金”指的是石油
C. 赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到目的的是
A. 用乙醇作萃取剂萃取溴水中的溴
B. 用燃烧法除去CO2中混有的少量CO
C. 用焰色反应鉴别Na2SO4溶液和NaCl溶液
D. 用加热法除去Na2CO3固体中的少量NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。某小组制备亚硝酸钠的实验装置如图所示(部分夹持装置已略去)。

已知:
①2NO+Na2O2=2NaNO2、2NaNO2+O2=2NaNO3
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2都能与MnO4-反应生成NO3-和Mn2+
回答下列问题:
(1)反应前需先打开弹簧夹,通入氮气排尽装置中的空气,原因是__________________。
(2)装置A中反应的化学方程式为_________________;装置B中的实验现象为_____________,铜片逐渐溶解并有气泡产生。
(3)若省略装置C,则装置D中的固体产物除NaNO2、NaOH外,还有__________、___________(填化学式)。检验产物中含有NaNO2的方法是:取少量样品于试管中,_____________________,则说明产物中含有NaNO2。
(4)装置E的作用是___________________________。
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O。根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,除样品外必须选用的物质有_________(填标号)。
a.白酒 b.碘化钾、淀粉溶液 c.白醋 d.白糖
(6)充分反应后,该小组设计实验检测产物中NaNO2的含量。称取装置D中固体2.3000g,完全溶解配制成溶液l00mL,取出25.00mL溶液用0.100mol·L-1酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),三次滴定平均消耗KMnO4溶液30.00mL,则样品中NaNO2的质量分数为_______________。(已知:NaNO2的摩尔质量为69g·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com