
【题目】自然界中氯化钠是由![]() 与
与![]() 和
和![]() 所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含
所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含![]() 的质量为( )
的质量为( )
A. 1.75g B. 1.85g C. 5.25g D. 5.55g
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
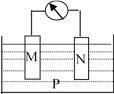
M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们在安徽发现了全国最大的钼矿。周期表中钼元素的相关信息如图所示,下列有关钼的说法错误的是
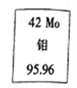
A. 95Mo原子核内有53个中子 B. 95Mo原子核外有42个电子
C. 92Mo、95Mo、98Mo为相同核素 D. 92Mo、95Mo、98Mo的化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度(烧碱中的杂质不和酸反应),请根据实验回答
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是 .
(2)用式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20molL﹣1的标准盐酸滴定待测液,判断滴定终点的现象是: .
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是(填答案字母序号)
A.c(Na+)>c(Cl﹣)>c(H+)>c(OH﹣)
B.c(Na+)>c(OH﹣)>c(Cl﹣)>c(H+)
C.c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣)
D.c(Cl﹣)+c(Na+)>c(OH﹣)+c(H+)
(5)根据下列数据计算,c(NaOH) mol/L
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.60 | 20.50 |
第二次 | 10.00 | 3.00 | 23.10 |
(6)经过分析发现,本次实验的测定结果比烧碱的实际纯度偏高,造成误差的可能原因是
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. SO2能使品红溶液褪色,是因为SO2具有氧化性将品红氧化
B. 9g 重水(D2O)中含有5mol质子
C. 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D. 同位素的物理性质和化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
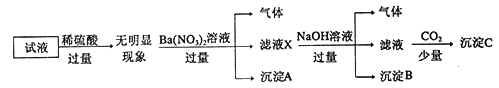
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石和碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]在生产生活中都有着极为重要的应用.某研究小组对用明矾石制取氢氧化铝等物质,以及碱式碳酸铝镁的组成展开了如下研究,请你参与并完成对有关问题的解答
(1)明矾石是制取化肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图1所示: 
①操作I的名称为
②混合肥料的主要成分是(写化学式).检验滤液Ⅱ中是否含有NH4+的方法是:取少货滤液Ⅱ于试管中,向其中加入适量的NaOH溶液,加热,若产生气体能够使 , 则证明滤液Ⅱ中含有NH4+
③一定条件下,下列物质能与沉淀Ⅱ发生反应的是(填字母)
a.KSCN 溶液 b.Al c.NaOH 溶液
④空气能够为沉淀反应提供足量的(写化学式).
(2)碱式碳酸铝镁是常见胃药“达喜”的主要成分.为确定碱式碳酸铝镁的组成,进行了如下实验:
①取碱式碳酸铝镁粉末6.02g,缓缓加入2.0molL﹣1盐酸使其充分混合反应,反应过程中产生气体的体积V(气体)和消耗盐酸的体积V(HC1)的关系如图2所示,则碱式碳酸铝镁中氢氧根与碳酸根的物质的量之比为
②将①反应后得到的混合液再和过量的氢氧化钠溶液充分混合,反应完全后经过过滤、洗涤、干燥得沉淀3.48g,则碱式碳酸铝镁的化学式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下。
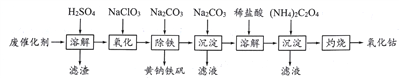
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是__________________。
(2)氧化:加热搅拌条件下加入NaC1O3,其作用是_______________________________。
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾Na2[Fe6(SO4)4(OH)12]沉淀。写出该反应的化学方程式:__________________________________________________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2·3Co(OH)2],沉淀需洗涤,检验沉淀是否洗涤干净的操作是_________________________________________________________。
(5)溶解:CoCl2的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是__________________________________。
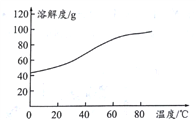
(6)灼烧:准确称取所得CoC2O4固体2.205g,在空气中灼烧得到钴的一种氧化物1.205g,写出该氧化物的化学式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水常用Cl2杀菌消毒,使水中含有Cl-,为了检验Cl-的存在,可选用的试剂是( )
A.酚酞溶液B.FeCl3溶液C.AgNO3溶液D.NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com