
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是

A. 电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池充电时间越长,电池中的Li2S2量越多
C. 电解质中加入硫酸能增强导电性
D. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的鉴别或检验错误的是
A.用激光笔照射区别食盐水和蛋白质溶液
B.向溶液中滴入铁氰化钾溶液,可检验溶液中是否存在Fe2+
C.将红色石蕊试纸伸到集气瓶口可检验瓶里是不是氨气
D.向溶液中滴入足量稀盐酸后再滴入氯化钡溶液,可检验溶液中是否存在SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH![]() 、Cl-、HS-
、Cl-、HS-
B.酸性溶液中可能大量存在Na+、CH3COO-、SO![]() 、I-
、I-
C.碱性溶液中可能大量存在Na+、K+、Cl-、AlO![]()
D.使甲基橙变黄色的溶液中可能大量存在Fe3+、K+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法中正确的是
A.室温下,盐酸中c(Cl-)与醋酸溶液中c(CH3COO-)相等,则两溶液的pH相等
B.将amol·L-1的醋酸溶液与0.01mol·L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),则醋酸的电离常数K=![]() (用含a的代数式表示)
(用含a的代数式表示)
C.向NH4Cl溶液中加入少量等物质的量浓度的稀盐酸,则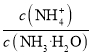 的值减小
的值减小
D.向Na[Al(OH)4]溶液中逐滴加入稀盐酸至沉淀恰好消失时:c(Cl-)=3c(Al3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、已知:SiHCl3在催化剂作用下可发生如下反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=30kJ·mol1
(1)写出由SiHCl3(g)分解产生SiH4(g)和SiCl4(g)的热化学方程式为__。
Ⅱ、298K时,溶液中存在如下反应:A(aq)![]() B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
c/(mol·L-1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
回答下列问题:
(2)该反应在50~80min内的平均反应速率为__mol·L1·min1。
(3)120min时A的转化率为__。
(4)298K时,该反应的平衡常数K=__,升温时平衡常数__(填“增大”、“减小”、或“不变”)。
(5)为提高A的平衡转化率,除适当控制反应温度外,还可采取的措施是__。
(6)下列叙述可说明可逆反应已达平衡的是__。
A.c(A)=c(B)
B.A和B反应速率相等
C.A和B的物质的量比值保持恒定
D.溶液的总质量保持恒定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法不正确的是

A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中涉及到非极性键的断裂和极性键的形成
C.反应II为:2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D.总反应为:2H2O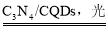 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、![]() 和
和![]() 存在于CO2和NaOH溶液反应后的溶液中,其物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
存在于CO2和NaOH溶液反应后的溶液中,其物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
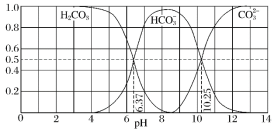
A.pH=10.25时,c(Na+)=c(![]() )+c(
)+c(![]() )
)
B.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D.若是0.1molNaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com